
| A、前2min SO2的平均反应速率0.01425mol(L?s) | B、平衡时,SO2的浓度为0.01425mol/L | C、平衡时,SO2的转化率为95% | D、平衡时,SO2的转化率为71.5% |
| ||
| 2min |
| 0.285mol |
| 10L |
| 0.285mol |
| 0.3mol |
| 0.285mol |
| 0.3mol |


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解
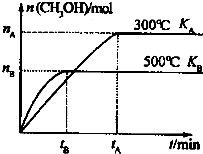 CO和H2与我们的生产和生活等方面密切相关.
CO和H2与我们的生产和生活等方面密切相关.| 1 |
| 2 |
| 1 |
| 2 |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: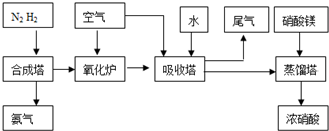
| 时间(h)浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | 0 | 0.200 | 0.600 | C3 | C3 |
| 1 |
| a |
| 1 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
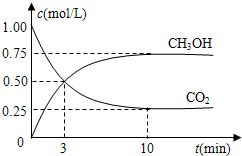
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
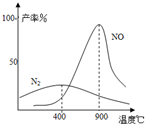
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:| c(H2)?c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com