
| A、①②⑤⑥ | B、①②③④ |
| C、①③⑤⑥ | D、①②③④⑤⑥ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2参加的任何反应,反应过程中转移电子数都是2NA |
| B、常温下,98g H2SO4和H3PO4的混酸中所含的分子数为NA |
| C、标准状况下,11.2L CCl4中含有的分子数目为0.5NA |
| D、常温常压下,2.24L NO2和CO2混合气体中含有的氧原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量钠投入饱和NaHCO3溶液中 |
| B、钠投入饱和食盐水中 |
| C、过量的CO2通入饱和CaCl2溶液中 |
| D、足量的BaCl2溶液加入NaHCO3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②和④等体积混合后的溶液中离子浓度大小为:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | ||||||
B、②升高温度,
| ||||||
| C、pH相同的①和②,物质的量浓度关系:①>② | ||||||
| D、①和③以体积比2:5混合,所得溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚氯乙烯常用做食品包装材料 |
| B、CO2和CH4都是温室效应气体 |
| C、用乙烷和乙烯分别与氯化氢反应都可得到氯乙烷 |
| D、苯和溴水既能发生取代反应又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氢元素的化合物中一定有氢键 |
| B、水结冰时,体积膨胀、密度减小都与水分子间形成氢键有关 |
| C、水加热到很高的温度都难以分解,这是由于氢键所致 |
| D、邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高,是因为前者氢键比后者强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
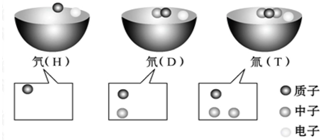
| A、H、D、T原子中质子数相同,核外电子数也相同 |
| B、H、D、T原子属于三种不同核素 |
| C、H、D、T原子互为同位素 |
| D、元素的原子都是由质子、中子、电子构成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com