

 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为 ×10-10或
×10-10或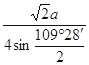 ×10-10或
×10-10或 ×10-10(3分,或其他合理答案)
×10-10(3分,或其他合理答案)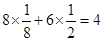 ;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。
;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。 ×10-10或
×10-10或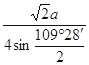 ×10-10或
×10-10或 ×10-10
×10-10

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题

| A.常温下,Z单质为气态物质 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的稳定性要比X的氢化物的稳定性强 |
| D.Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.简单离子半径:Y>X |
| B.最高价氧化物对应水化物的酸性:Z>Y |
| C.W与X形成的化合物属于离子化合物 |
| D.W、X、Z只能形成一种化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
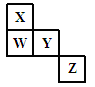
| A.Z元素一定是金属元素 |
| B.X、Y、W一定是主族元素 |
| C.若Y的单质既能与强酸溶液反应又能与强碱溶液反应,则W为ⅡA元素 |
| D.Z既可能在第三周期,也可能在第四周期 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| J | | Q |
| | | R |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.L、M、X三元素位于同一族 |
| B.K、Z两元素的氢化物的水溶液都显酸性 |
| C.Y元素对应的氢化物比K元素对应的氢化物沸点低 |
| D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯气与氢气反应生成氯化氢,而硫与氢气反应生成硫化氢 |
| B.向硫化氢的水溶液中通入氯气可得到淡黄色的硫 |
| C.氯气能与水反应而硫不能 |
| D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MgCl2 | B.CaCl2 | C.SiO2 | D.CS2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com