
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| 0.012 |
| 0.032 |
| 0.0540mol |
| 2 |


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、32g O2中所含氧原子数为NA个 |
| C、1mol氧约含6.02×1023个O2 |
| D、摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
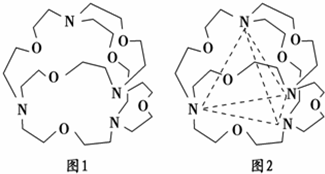 2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.
2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
35 17 |
37 17 |

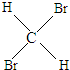 与
与 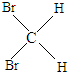
查看答案和解析>>
科目:高中化学 来源: 题型:
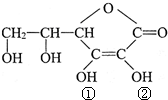 维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,结构如图,下列关于维生素C正确的是( )
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,结构如图,下列关于维生素C正确的是( )| A、维生素C能使酸性高锰酸钾溶液褪色 |
| B、维生素C由于含有酯基而难溶于水 |
| C、维生素C酸性可能是①②两个羟基引起的 |
| D、维生素C由于含有C=O键而能发生银镜反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com