
【题目】丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+![]() O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
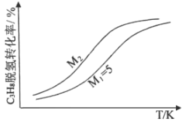
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
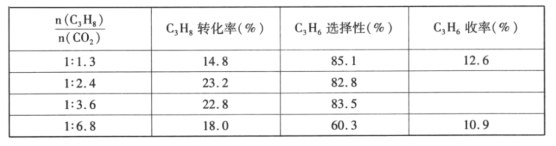
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中![]() 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时![]() 的配比是___。
的配比是___。
【答案】+125kJ/mol 20% 5000 B > C+CO2=2CO有利于消除积炭 1:2.4
【解析】
反应C3H8(g)=C3H6(g)+H2(g)可由C3H8(g)+![]() O2(g)=C3H6(g)+H2O(g)与H2(g)+
O2(g)=C3H6(g)+H2O(g)与H2(g)+![]() O2(g)=H2O(g)相减得到;反应①反应前后气体分子数增加的吸热反应;恒压下充入高温水蒸气,容器的体积增大,相当于减小压强,压强减小,平衡向气体分子数增加的方向移动。
O2(g)=H2O(g)相减得到;反应①反应前后气体分子数增加的吸热反应;恒压下充入高温水蒸气,容器的体积增大,相当于减小压强,压强减小,平衡向气体分子数增加的方向移动。
(1)根据盖斯定律,反应①的ΔH1=ΔH2-ΔH3=-117kJ/mol+242kJ/mol=+125kJ/mol。
(2)根据反应方程式,反应后增加的压强与反应生成的C3H6、H2的压强及反应了的C3H8的压强相等,故C3H8的转化率为20%;平衡时C3H6、H2压强为20%![]() 105 Pa =2
105 Pa =2![]() 104 Pa,平衡时C3H8的压强为105Pa-20%
104 Pa,平衡时C3H8的压强为105Pa-20%![]() 105 Pa=8
105 Pa=8![]() 104 Pa,则平衡常数Kp=
104 Pa,则平衡常数Kp=![]() ;要提高C3H8的平衡转化率,则平衡正向移动,该反应为吸热反应,则提高温度,C3H8的平衡转化率增大;增大C3H8的浓度平衡虽正向移动但C3H8的平衡转化率减小,故答案选B。
;要提高C3H8的平衡转化率,则平衡正向移动,该反应为吸热反应,则提高温度,C3H8的平衡转化率增大;增大C3H8的浓度平衡虽正向移动但C3H8的平衡转化率减小,故答案选B。
(3) 恒压下充入高温水蒸气,容器的体积增大,平衡正向移动,则温度一定时,水烃比越大,C3H8的平衡转化率越高,故M2>5。
(4)高温会加剧催化剂表面积炭,导致催化剂迅速失活,加入CO2发生反应C+CO2=2CO,有利于消除积炭,保持催化剂活性;由表格数据可知,![]() 的配比是1:2.4,C3H6的选择性大,C3H8转化率高,则C3H6收率最高。
的配比是1:2.4,C3H6的选择性大,C3H8转化率高,则C3H6收率最高。


科目:高中化学 来源: 题型:
【题目】某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) Cu2+ + 2OH- Ksp = 2.2×10-20;![]() Cu2+ + 4NH3 K = 4.8×10-14
Cu2+ + 4NH3 K = 4.8×10-14
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。

(实验 1)CuSO4 溶液和浓氨水的反应。
序号 | 实验内容 | 实验现象 |
1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有![]() ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
序号 | 实验内容 | 实验现象 |
2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
序号 | 实验内容 | 实验现象 |
2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1L0.lmol/L的Na2SiO3溶液中含阴离子总数为0.1NA个
B.0.1mol的2H37Cl分子的中子数是2.1NA
C.7.8gNa2O2与足量水充分反应转移的电子数目为0.2NA
D.1mol雄黄(As4S4),结构如图:![]() ,含有4NA个S-S键
,含有4NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
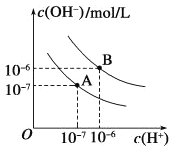
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________。
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr在周期表中的位置___;其原子核外电子排布的最高能层符号为___。
(2)在1molCrO5(其中Cr为+6价)中,含有过氧键的数目为__。
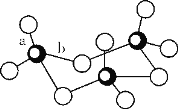
(3)钒(23V)广泛用于催化及钢铁工业,被称之为“工业的味精”。写出钒原子价电子排布图___;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___。
(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是____。(填元素符号)
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。CaTiO3晶胞如图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___nm,与Ti紧邻的O个数为___。
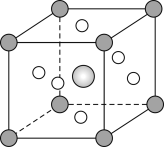
(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于___位置,O处于___位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________kJ/mol。
II.对于反应CO(g)+H2O(g)CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为![]() ,则反应的平衡常数K=______。
,则反应的平衡常数K=______。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是______,500K时p(CO)随时间变化关系的曲线是_______。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从某烃A合成一种染料中间体DSD酸。(试剂和条件已略去)
A![]() B
B![]() CD
CD
已知:
①B的结构简式为![]()
②![]()
![]()
![]()
③![]()
![]()
![]() (-NH2易被NaClO氧化)
(-NH2易被NaClO氧化)
④2![]()
![]()

请回答下列问题
(1)A的结构简式_____________________________________;
(2)C的结构简式_____________________________________;
(3)D的结构简式_____________________________________。
(4)A到B的反应方程式为_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com