
【题目】下列关于Fe(OH)3胶体和MgCl2溶液性质叙述正确的是
A. 均能够产生丁达尔效应 B. 微粒直径均在1~100 nm之间
C. 分散质微粒均可透过滤纸 D. 加入少量NaOH 溶液,只有MgCl2溶液产生沉淀
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】关于配合物[Zn(NH3)4]Cl2的说法正确的是( )
A.配位数为6
B.配体为NH3和Cl﹣
C.[Zn(NH3)4]2+为内界
D.Zn2+和NH3以离子键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A. K+、Na+、Cl-、NO3- B. K+、NO3-、OH-、HCO3-
C. Na+、OH-、Cl-、NO3- D. MnO4-、K+、S2-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H=a kJ mol-1 。
O2(g) △H=a kJ mol-1 。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
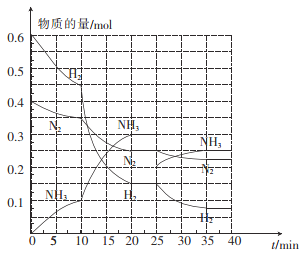
① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合处理“工业三废”,有利于保护环境,节约资源. 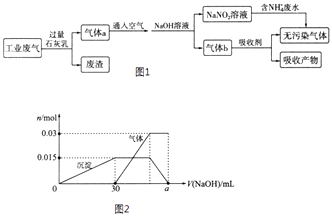
(1)为处理某工厂的工业废气(主要含N2、SO2、NO、CO,不考虑其他成分),设计了如图1流程:
已知:NO+NO2+2NaOH=2NaNO2+H2O;
2NO2+2NaOH=NaNO3+NaNO2+H2O.
①废渣的成分为(填化学式).
②通入空气不能过量,原因是 .
③吸收剂所吸收的气体主要是
④处理含NH4+废水时,发生反应的离子方程式为
(2)某无色工业废水中可能含有NH4+、Na+、Al3+、Cu2+、Cl﹣、SO42﹣、CO32﹣等离子中的几种离子.为确定其成分,设计如下实验:
a.取10mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,充分反应后过滤得到0.04mol白色沉淀,向滤液中加入AgNO3溶液无沉淀产生.
b.另取10mL该废水于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解.沉淀和气体的物质的量随加入NaOH溶液体积的变化关系如图2所示.(不考虑沉淀、气体的溶解和损失)
根据上述实验和图表数据:
①该废水中一定含有的离子有(填离子符号).
②实验室配制100mL所需浓度的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称).
③图中a= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)![]() 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
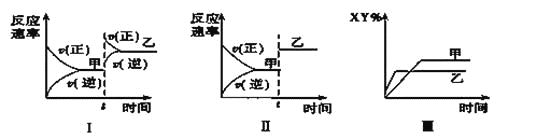
A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________。
(3)爆炸残留在废水中的CN-可以用Cr2O![]() 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
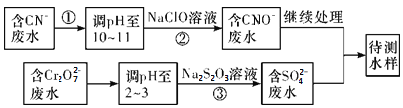
①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________;
③步骤③中,每处理0.4 mol Cr2O![]() 时转移电子2.4 mol,该反应的离子方程式_________;
时转移电子2.4 mol,该反应的离子方程式_________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com