
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.人类目前所直接利用的能量大部分是由化学反应产生的 |
| B.煤、石油、天然气是当今世界最重要的三种化石燃料 |
| C.我国目前最重要的能源是煤炭 |
| D.人体运动所消耗的能量与化学反应无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲 | C(HA)=0.2 mol·L-1 | C(NaOH)=0.2mol·L-1 | pH=a |
| 乙 | C(HA)=c1 mol·L-1 | C(NaOH)=0.2mol·L-1 | pH=7 |
| 丙 | C(HA)="0.1" mol·L-1 | C(NaOH)=0.1mol·L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
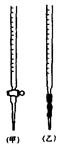
| A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤 |
| B.滴定前尖嘴部分有一气泡,滴定终点时消失 |
| C.定容时,俯视刻度线 |
| D.滴定前仰视读数,滴定后俯视读数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将pH=4的醋酸溶液稀释后,H+浓度增大 |
| B.常温下,0.01LpH=10的NaOH溶液加水稀释到10L,此时溶液的PH=7 |
| C.改变条件使醋酸的电离平衡向右移动,醋酸的电离度一定增大 |
| D.常温下0.1mol·L-1醋酸溶液的pH=a,加入适量的醋酸钠固体能使溶液pH=(a+1) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据一次能源和二次能源的划分,氢气是二次能源 |
| B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 |
| C.火电是将燃料中的化学能直接转化为电能的过程 |
| D.在火电过程中,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com