
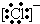 ③
③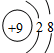 ④F- 其中核外电子数相同的是( )
④F- 其中核外电子数相同的是( )| A. | ①③ | B. | ②③④ | C. | ②④ | D. | ①③④ |
分析 原子中:核外电子数=质子数=原子序数,
离子中:阳离子核外电子数=质子数-所带电荷数,阴离子核外电子数=质子数+所带电荷数,据此解答.
解答 解:①13Al3+,质子数是13,原子的电子数是13,由原子失去3个电子变成阳离子,所以该阳离子有10个电子;
②根据电子式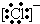 知,该离子最外层8个电子,氯原子为17号元素,内层有10个电子,所以该离子共有17+1=18个电子;
知,该离子最外层8个电子,氯原子为17号元素,内层有10个电子,所以该离子共有17+1=18个电子;
③根据离子结构示意图知,核外电子数为2+8=10,电子数是10;
④F-是由F原子得1个电子生成的,F原子有9个电子,所以F-核外有10个电子;
故选:D.
点评 本题考原子结构示意图、离子中微粒之间的关系,注意理解离子中质子数、核外电子数、电荷之间的关系,注意无论原子变成离子,还是离子变成原子,变化的是核外电子数,不变的是核内质子数和核电荷数,题目比较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
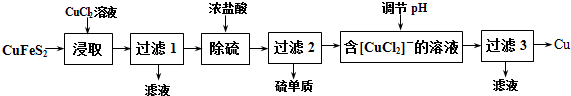
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 用热的纯碱溶液清洗油污效果好 | |
| C. | 在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深 | |
| D. | 常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
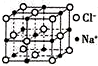 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症. ,未成对电子数为5.
,未成对电子数为5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
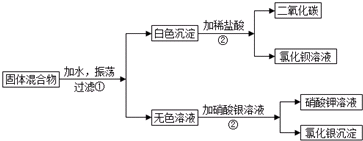
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将BaSO4放入水中不能导电,所以硫酸钡不是电解质 | |
| B. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| C. | 氯化氢溶于水能导电,但液态氯化氢不能导电 | |
| D. | 固态的NaCl不导电,熔融态NaCl可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2、SiO2中的S、C、Si均为sp3杂化 | |
| B. | SO32-、CO32-、SiO32-均为平面三角形 | |
| C. | H3O+、NH4+、[Cu(NH3)4]2+均含有配位键 | |
| D. | 石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com