
 (1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.
(1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.分析 (1)①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,该反应是可逆反应,取1molN2和3molH2放在一密闭容器中,不能完全反应生成2mol氨气;
②可逆反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,该反应为体积减小的放热反应,改变反应条件平衡移动,根据各时刻的速率变化判断平衡移动移动方向,据此判断NH3的含量变化,据此解答;
③根据温度、催化剂以及压强对反应速率的影响分析,注意各时间段正逆反应速率的变化,t4~t5,正、逆反应速率都降低,但逆反应速率大于正反应速率,导致平衡向逆反应方向移动;
(2)根据氨水电离生成等量的铵根离子和氢氧根离子,求出平衡时各离子的浓度,在利用电离平衡常数的表达式计算出NH3•H2O的电离平衡常数;
(3)根据Ksp[Al(OH)3]=1.0×10-33求出氢氧根离子浓度.
解答 解:(1)①热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol表示1mol氮气(g)与3mol氢气(g)生成2mol氨气(g)反应的热量为92.4kJ,由于该反应是可逆反应,加入1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ,
故答案为:小于;
②可逆反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,该反应为体积减小的放热反应,
t0~t1,正、逆反应速率相等,平衡不移动;
t1~t2,正、逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆反应方向移动,导致氨气的含量降低,氨气含量较t0~t1低;
t2~t3,正、逆反应速率相等,处于平衡状态,氨气的含量不变,氨气含量较t1~t2低;
t3~t4,正、逆反应速率都同等程度的增大平衡不移动,氨气的含量不变,氨气含量与t2~t3相同;
t4~t5,正、逆反应速率都降低,但逆反应速率大于正反应速率,导致平衡向逆反应方向移动,氨气的含量降低;
t5~t6,正、逆反应速率相等,平衡不移动,氨气的含量不变,氨气含量较t4~t5低;
所以NH3的含量最高的一段时间是t0~t1,
故答案为:A;
③t4时,正逆反应速率都减小,且逆反应速率大于正反应速率,平衡向逆反应方向移动,由方程式计量数关系可知,应为减小压强的变化,
故答案为:减压;
(2)氨水溶液PH=11,则c(H+)═10-11 mol•L-1,c(0H-)═10-3mol•L-1,
NH3•H2O?NH4++OH-
起始(mol•L-1) 0.1 0 0
反应(mol•L-1)-)10-3 10-3 10-3
平衡(mol•L-1) 0.1 10-3 10-3
NH3•H2O的电离平衡常数为:$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=1.0×10-5;
向此溶液中加入少量的氯化铵固体,溶液中铵离子浓度增大,氨水的电离程度减小,所以氢氧根离子浓度减小,此时$\frac{C(N{{H}_{4}}^{+})}{C(O{H}^{-})}$值将增大,
故答案为:1.0×10-5; 增大;
(3)0.001mol/LAlCl3溶液中铝离子浓度为0.001mol/L,带人Ksp[Al(OH)3]=c(Al3+)×[c(OH-)]3可得:c(OH-)=1.0×10-10mol/L,常温下,氢离子浓度为:1.0×10-4mol/L,溶液pH=4,
故答案为:4.
点评 本题考查了化学平衡移动图象、电离平衡等,题目难度中等,注意掌握化学平衡状态的判断方法、化学反应的可能性,电离平衡常数的计算方法.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题

| A. | 牙膏是中性物质 | B. | 草木灰可改良碱性土壤 | ||
| C. | 胃酸过多的人不宜多吃橘子 | D. | 食醋能使无色酚酞变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗径与烧杯内壁 | |
| C. | 往试管中添加液体时,试剂瓶口与试管口 | |
| D. | 用胶头滴管向试管滴液体时,滴管尖端与试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液时使用的烧杯未洗涤 | B. | 定容时俯视读取刻度线 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 转移时有少量溶液流出瓶外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题




 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
.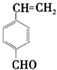 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3水解使溶液呈酸性,并能起净水作用,使水中悬浮的杂质沉降 | |
| B. | 浓度为5mol•L-1和0.5mol•L-1的两种FeCl3溶液,其它条件相同时,Fe3+离子的水解程度前者比后者低 | |
| C. | 加热FeCl3溶液并蒸干,再灼烧,此时得到的固体是无水氯化铁 | |
| D. | 为了抑制Fe3+的水解,更好地保存FeCl3溶液,应向其中加入少量的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com