
据报道,我国拥有完全自主产权的氢氧燃料电池车在广州亚运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A、正极反应式为:O2+2H2O+4e-===4OH-
B、工作一段时间后,电解液中KOH的物质的量不变
C、该燃料电池的总反应方程式为:2H2+O2===2H2O
D、用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
科目:高中化学 来源: 题型:
下列关于化学与生产、生活的认识不正确的是
A.合理开发利用可燃冰(固态甲 烷水合物)有助于缓解能源紧缺的状况
烷水合物)有助于缓解能源紧缺的状况
B.为防止电池中的重金属等污染土壤或水体,应积极开发废电池的综合利用技术
C.为防止纸张被酸腐蚀,可在纸浆中加入碳酸钙等添加剂
D.海水提镁的主要步骤为:海水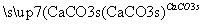 Mg(OH)2(s)
Mg(OH)2(s)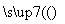 MgCl2(aq)
MgCl2(aq)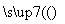 Mg(l)+Cl2(g)
Mg(l)+Cl2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
醇和酚在人类生产和生活中扮演着重要的角色,根据醇和酚的概念和性质回答下列问题。
(1)下列物质属于醇类的是________。
①CH2===CH—CH2OH ②CH2OH—CH2OH
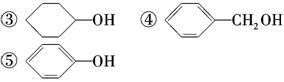
(2)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为: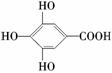 ,用没食子酸制造墨水主要利用了________类化合物的性质(填代号)。
,用没食子酸制造墨水主要利用了________类化合物的性质(填代号)。
A.醇 B.酚
C.油脂 D.羧酸
(3)尼泊金酯( )是国际上公认的广谱性高效食品防腐剂,是国家允许使用的食品添加剂。
)是国际上公认的广谱性高效食品防腐剂,是国家允许使用的食品添加剂。
①下列对尼泊金酯的判断不正确的是________。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.与浓溴水反应时,1 mol尼泊金酯消耗1 mol Br2
②尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-===Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A、①②
B、②③
C、②④
D、③④
查看答案和解析>>
科目:高中化学 来源: 题型:
对于锌-铜-稀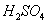 组成的原电池装置中,当导线中有
组成的原电池装置中,当导线中有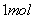 电子通过时,理论上的电极变化
电子通过时,理论上的电极变化
①锌片溶解了32.5g②锌片增重32.5g③铜片上析出了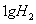 ④铜片上析出
④铜片上析出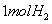
A、①③
B、①④
C、②③
D、②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A、钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大
B、电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少
C、在镀件上电镀锌,可以用锌作阳极,也可以用惰性电极材料作阳极
D、工作时在原电池的负极和电解池的阴极上都是发生失电子过程
查看答案和解析>>
科目:高中化学 来源: 题型:
把a,b,c三块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;b、c相连时,c不易被腐蚀。则三种金属的活动性由强到弱的顺序为( )
A.a>b>c B.a>c>b C.c>b>a D.b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com