

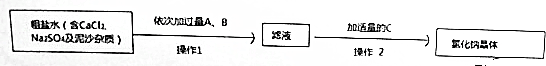
分析 (1)为检测PAFC中Al和Fe含量,PAFC加入足量A为氢氧化钠溶液反应生成氢氧化铁沉淀和偏铝酸钠溶液,氯化钠溶液,过滤后得到氢氧化铁灼烧得到C为氧化铁,滤液Ⅰ中通入过量的B为二氧化碳气体和偏铝酸钠溶液反应生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到D为氧化铝;
①步骤Ⅰ中的试剂A为氢氧化钠溶液;
②步骤Ⅲ的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀;
③依据固体灼烧所需陶瓷仪器为坩埚,泥三角分析;
(2)铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度,铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁,溶解于硫酸中铁可以还原铁离子为亚铁离子分析书写离子方程式.
解答 解:(1)为检测PAFC中Al和Fe含量,PAFC加入足量A为氢氧化钠溶液反应生成氢氧化铁沉淀和偏铝酸钠溶液,氯化钠溶液;过滤后得到氢氧化铁灼烧得到C为氧化铁,滤液Ⅰ中通入过量的B为二氧化碳气体和偏铝酸钠溶液反应生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,灼烧得到D为氧化铝;
①步骤Ⅰ中的试剂A为氢氧化钠溶液,故答案为:氢氧化钠溶液;
②步骤Ⅲ的反应为偏铝酸钠溶液中通入过量二氧化碳气体生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
③实验室进行“灼烧”是灼烧氢氧化铝固体,固体灼烧所需陶瓷仪器为坩埚、泥三角;
故答案为:坩埚、泥三角;
(2)由于Al、Fe以及Fe2O3的物质的量关系无法确定,则不能确定溶液中Fe元素的存在形成是否有Fe3+,所得酸性溶液中,不能确定是否一定存在的阳离子为Fe3+;铝热反应需要引发剂引发高温反应,用少量氯酸钾和镁条引发,点燃镁条燃烧放热使氯酸钾分解生成氧气助燃产生反应引发所需要的温度发生反应,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无铁离子,但不能说明固体中不含氧化铁,因为铝热反应生成铁溶解于硫酸中铁可以还原铁离子为亚铁离子,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,不能确定该固体混合物中无Fe2O3;
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;否;Fe+2Fe3+=3Fe2+.
点评 本题考查了铝及其化合物性质的分析应用,为高频考点,侧重于学生的分析、实验能力的考查,本题注意过程的分析判断,实验基本操作的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 解释或结论 |
| A | 过量的铁粉中加入稀硝酸中,充分反应后,滴入KSCN溶液,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | AgI固体中滴入KCl溶液,沉淀由黄色变为白色 | AgI比AgCl难溶 |
| C | 铝箔插入稀硝酸中,无现象 | 铝箔表面被硝酸氧化,形成致密的氧化膜 |
| D | 苯酚溶液中滴加溴水,出现白色沉淀 | 苯酚易发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol 对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数等于2NA | |
| D. | 1mol Fe 与足量的硝酸反应,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (g)△H=-106kJ•mol-1
(g)△H=-106kJ•mol-1 +AgO 快
+AgO 快| A. | 反应的活化能等于106kJ•mol-1 | |
| B. | AgO2也是反应的催化剂 | |
| C. | 增大乙烯浓度能显著提高环氧乙烷的生成速率 | |
| D. | 理论上0.7mol乙烯参与反应最多可得到0.6mol环氧乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,
将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯是1825年由俄国科学家门捷列夫发现的 | |
| B. | 苯与乙烯一样,是很重要的化工原料,可作消毒剂、有机溶剂、洗涤剂 | |
| C. | 苯的分子式中碳原子远没有饱和,因此能使溴水和高锰酸钾褪色 | |
| D. | 苯环上的碳碳键是一种介于单键和双键的独特的键,苯既能发生取代反应也能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com