�״��ֳơ�ľ����������Ҫ���ܼ��ͻ����л�ԭ�ϣ���ҵ�ϳ���CO��H
2Ϊԭ�Ϻϳɼ״���
��1����֪ÿ1gҺ̬�״�����ȫȼ������һ����̼��Һ̬ˮʱ�ų�13.8kJ������д���״�����ȫȼ�յ��Ȼ�ѧ����ʽ��
��
��2����ҵ�ϳ����÷�Ӧ��CO��g��+2H
2��g��=CH
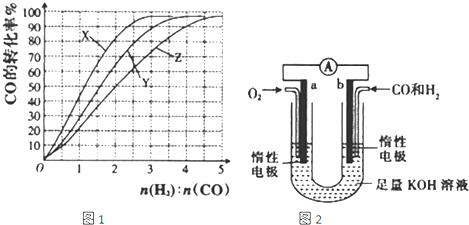
3OH��g����H��0�ϳɼ״�������230��270���·�Ӧ��Ϊ������Ϊ�о��ϳ�������ʵ���ʼ��ɱȣ���230�桢250���270�����ʵ�飬�����ͼ��ʾ����230��ʱ��ʵ��������Ӧ��������
������ĸ����ͬ�������¶��¹�ҵ�������˲��õĺϳ������n��H
2����n��CO���ı�ֵ��Χ��
��
A.1��1.5B.2.5��3C.3.5��4.5
��3���Ƽ״�����Ҫ���������������з�Ӧ��ȡ��HO
2��g��+CO��g��?H
2��g��+CO
2��g����H��0
150��ʱ�����ݻ�Ϊ2L�ĺ��º����ܱ������г���1mol CO��2molH
2O��g������Ӧ�ﵽƽ�����H
2���������Ϊ25%��
��ƽ��ʱCO��ת����Ϊ
��
��150���£�����ʼʱ����2molCO��4molH
2O��g������Ӧ�ﵽƽ��ʱCO
2���������Ϊ
��
��4��ij�о�С���������ͼ��ʾ��ԭ���װ�ã�����ͨ�����ʵ���֮��Ϊ1��1��CO��H
2������壨CO��H
2ͬʱ�ŵ磩��
�ٵ�ع���һ��ʱ��������Һ��pH
�����������С�����䡱����
�ڵ�ع���һ��ʱ���õ������Һ����6.2g��������δ��Ӧ������ܽ⣩�����μӷ�Ӧ����������Ϊ
��




 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д� A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д�