
下列有关说法正确的是
A.原子最外层电子数为2的元素一定是ⅡA元素
B.第三周期元素对应的离子半径从左往右依次减小
C.第ⅦA族元素从上到下,其氢化物的酸性逐渐减弱
D.第三周期的主族元素的最高正价一定等于其最外层电子数
科目:高中化学 来源:2016届湖北省高三优录班8月月考化学试卷(解析版) 题型:填空题
(15分)[选修3—物质结构与性质]钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。
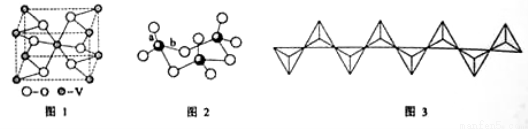
(4)V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 ____ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市高三第一学期第一次月考化学试卷(解析版) 题型:选择题
藜芦醇  广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是
广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是
A.1 mol, 1 mol B.3.5 mol, 7 mol
C.3.5 mol, 6 mol D.6 mol, 7 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二上第一次月考化学试卷(解析版) 题型:实验题
(12分)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____,直到因加入一滴盐酸后,溶液由 色变为 色,并______为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
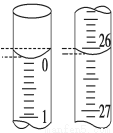
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL,终点读数为_____mL,所用盐酸溶液的体积为_____mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三第一次质量检测化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值.下列叙述正确的是
A.标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间
B.0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L
C.0.2 mol•L﹣1 Na2S溶液中含有的S2﹣数目小于0.2NA
D.在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是
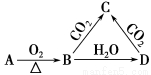
A.溶液呈碱性 B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体 D.受热易分解
查看答案和解析>>
科目:高中化学 来源:2016届全国推荐高三联考(二)化学试卷(解析版) 题型:选择题
向Al2 (SO4)3溶液中逐滴加入Ba(OH) 2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系如图所示,资料表明Ba( AlO2) 2可溶于水。下列有关叙述错误的是
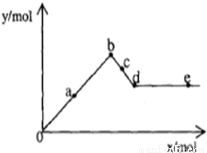
A.线段Ob:Al(OH) 3沉淀和BaSO4 沉淀共存
B.线段cd:溶液中c( AlO2-)>c(Ba2+)
C.线段ad:n(BaSO4)>n[Al(OH)3]
D.线段de:溶液中n(Ba2+)始终不等于n(OH-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷(解析版) 题型:实验题
(11分)为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

(1)将仪器连接好以后,必须进行的第一步操作是_________ ____。
(2)此实验还必须用到的最重要的仪器是_______;仪器F的作用是_______。
(3)已知仪器C中装有品红溶液,其作用是________ ___。
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.酸性高锰酸钾溶液
c.品红溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.碱石灰
g.无水硫酸铜
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是_____。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一9月检测化学试卷(解析版) 题型:简答题
写出下列反应的离子方程式(每小题1分,共4分)
(1)铝与氢氧化钾浓溶液反应
(2)向偏铝酸钠溶液中通过量二氧化碳
(3)向NaHSO 4 溶液中加入Ba(OH)2 使溶液呈中性
(4)过氧化钠与稀食盐水反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com