
 向电解质溶液中加入新物质时,其导电性符合如图所示变化趋势的实验操作是②.
向电解质溶液中加入新物质时,其导电性符合如图所示变化趋势的实验操作是②.分析 电解质溶液导电能力主要取决于自由移动离子浓度的大小,另外电荷数越高,导电能力越强.
①由2NaOH+Cl2═NaCl+NaClO+H2O 和Cl2+H2O=HCl+HClO,分析溶液中离子浓度变化;
②MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓,离子浓度减小,Ba(OH)2溶液过量时,离子浓度开始增大;
③乙酸和一水合氨都是弱电解质,二者反应生成强电解质醋酸铵,增大了溶液中的离子浓度;
④磷酸是弱电解质,磷酸和过量NaOH反应生成强电解质磷酸钠,使溶液中离子浓度增大,导电能力增强.
解答 解:①由2NaOH+Cl2═NaCl+NaClO+H2O 可知,离子浓度基本不变,导电能力基本不变,当氯气过量时,Cl2+H2O=HCl+HClO,溶液中离子浓度增大,导电能力增强,与图象不符;
②由MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓可知,离子浓度减小,导电能力减小,Ba(OH)2溶液过量时,离子浓度开始增大,导电能力增强,与图象相符;
③乙酸和一水合氨都是弱电解质,二者反应生成强电解质醋酸铵,增大了溶液中的离子浓度,导电能力增强,与图象不符;
④磷酸是弱电解质,磷酸和过量NaOH反应生成强电解质磷酸钠,使溶液中离子浓度增大,导电能力增强,与图象不符;
故答案为:②.
点评 本题考查了电解质溶液的导电性,难度中等,掌握影响电解质溶液导电能力的因素是基础,明确选项中发生的化学反应是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | α2=α3<α4<α1 | B. | α3=α2<α1<α4 | C. | α2<α3<α1<α4 | D. | α1<α2<α3<α4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
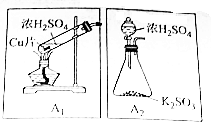 二氧化硫(SO2)是中学化学中常见的气体,在生产生活中用途广泛,某化学课题小组对其进行了实验探究,方案如下:
二氧化硫(SO2)是中学化学中常见的气体,在生产生活中用途广泛,某化学课题小组对其进行了实验探究,方案如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦⑨ | B. | ②④⑥⑧⑩ | C. | ②⑦⑧⑩ | D. | ②⑤⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L四氯化碳的分子数约为NA个 | |
| B. | 将含1molFeCl3的饱和溶液制成胶体,最后得到NA个Fe(OH)3胶粒 | |
| C. | 6.5gZn与足量HNO3反应,转移0.2NA个电子 | |
| D. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol•L-1,则Na+个数为2NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列变化中,属于吸热反应的是( )
①液态水的 汽化 ②将胆矾加热变为白色粉末
汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g) CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 131I是一种新发现的元素 | |
| B. | 我们平常食用的加碘盐就是含有碘单质的食盐 | |
| C. | 卤素F、Cl、Br、I中,I的电负性和第一电离能都最小 | |
| D. | 碘单质易升华是由于碘原子半径大,共价键键能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com