
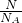 计算氧原子的物质的量,结合二氧化碳的分子式计算碳原子的物质的量.
计算氧原子的物质的量,结合二氧化碳的分子式计算碳原子的物质的量. 计算氧原子的物质的量,再根据N=NA计算氧原子数目.
计算氧原子的物质的量,再根据N=NA计算氧原子数目.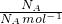 =1mol,氧原子与碳原子的物质的量之比为2:1,所以碳原子的物质的量为1mol×
=1mol,氧原子与碳原子的物质的量之比为2:1,所以碳原子的物质的量为1mol× =0.5mol,故A错误;
=0.5mol,故A错误;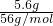 ×2×NAmol-1=0.2NA,故B错误;
×2×NAmol-1=0.2NA,故B错误;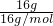 ×NAmol-1=NA,故C正确;
×NAmol-1=NA,故C正确;

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com