
| 150×59.7% |
| 16 |
| 5×16 |
| 59.7% |
| 150×59.7% |
| 16 |
| 5×16 |
| 59.7% |
| 134×35.82% |
| 12 |
| 134×4.48% |
| 1 |
 ,故答案为:
,故答案为: ;
; ,分子中连接羟醛的碳原子连接4个不同的原子灰基团,是手性碳原子,用*符号标出为
,分子中连接羟醛的碳原子连接4个不同的原子灰基团,是手性碳原子,用*符号标出为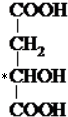 ,故答案为:
,故答案为: .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
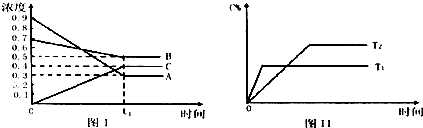
| A、在时间为t1时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| B、在时间为t1时,保持温度和压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,T℃时由0.6 mol/LA、0.6mol/LB、0.2mol/LC开始反应,达到平衡后C的浓度仍为0.4mol/L |
| D、其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molFeCl3完全转化成氢氧化铁胶体后生成 NA个胶粒 |
| B、1molH2O2与MnO2充分作用后,转移2NA个电子 |
| C、标准状况下,22.4升H2与4克氦气均含NA个分子 |
| D、50℃,1×105Pa下46克NO2与0℃,2×105Pa下46克N2O4均含有3NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .如图所示是九种化合物的转变关系.
.如图所示是九种化合物的转变关系.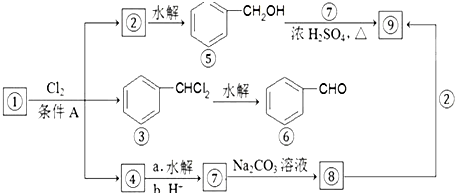
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

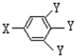 (其中:-X、-Y均为官能团)
(其中:-X、-Y均为官能团)查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液的体积/mL | 0.1000mol?L-1 Na2S2O3的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:
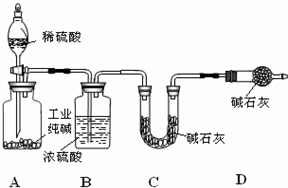 工业纯碱中常含有NaCl、Na2SO4杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:
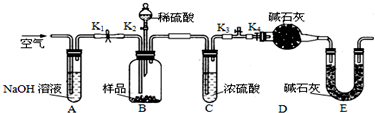
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com