
分析 ①结合n=cV计算离子的物质的量,判断过量,由沉淀后溶液中氯离子浓度、结合Ksp计算溶液中银离子浓度;
②沉淀前后溶液中氢离子物质的量不变,由混合后氢离子的浓度计算pH.
解答 解:①向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,混合后两者浓度分别为c(Ag+)=$\frac{0.05L×0.018mol/L}{0.1L}$=0.009 mol/L、c(Cl-)=$\frac{0.05L×0.02mol/L}{0.1L}$=0.01mol/L,Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.01-0.009=0.001mol/L,
Ksp=c(Ag+)×C(Cl-)=1.0×10-10,则:c(Ag+)=$\frac{1.0×1{0}^{-10}}{0.001}$=1.0×10-7mol/L,
答:沉淀生成后溶液中c(Ag+)是1.0×10-7mol/L;
②沉淀生成后,氢离子浓度为$\frac{0.05L×0.02mol/L}{0.1L}$=0.01mol/L,所以pH=-lg10-2=2,
答:沉淀生成后溶液的pH是2.
点评 本题考查难溶电解质的生成及Ksp计算,为高频考点,把握过量判断、Ksp计算为解答的关键,侧重分析与计算能力的考查,注意等体积混合后离子浓度变化,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 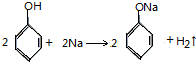 | B. | 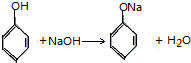 | ||
| C. | 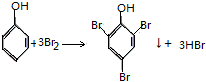 | D. | 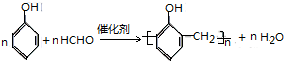 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
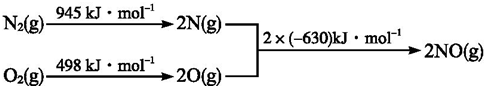
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 +HNO3(浓)$→_{△}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
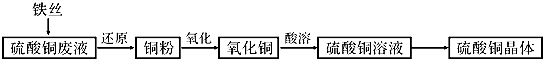
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  打磨磁石制指南针 | B. |  烧结粘土制陶瓷 | ||
| C. |  湿法炼铜 | D. |  铁的冶炼 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
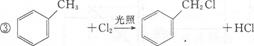
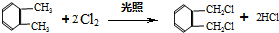 .
.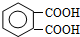 +2CH3CH2OH
+2CH3CH2OH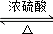
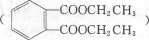 +2H2O.
+2H2O.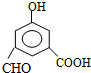 ,每种同分异构体中,化学环境不同的氢原子都是6种.
,每种同分异构体中,化学环境不同的氢原子都是6种.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入足量NH3,产生沉淀 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 盛放氢氧化钠溶液的试剂瓶用橡皮塞,不用玻璃塞 | |
| D. | Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的转化率变小 | B. | 平衡向逆反应方向移动 | ||
| C. | D的质量百分数变大 | D. | a<c+d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com