
【题目】在2CH4(g)+2NH3(g)+3O2(g)=2HCN(g)+6H2O(g)反应中,已知v (HCN)=n mol/(Lmin),且v(O2)=m mol/(Lmin),则m与n的关系正确的是( )
A.m= ![]() n
n
B.m= ![]() n
n
C.m= ![]() n
n
D.m=2n
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.只有化学键形成的变化不一定是化学变化
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.若两种元素原子的最外层电子数相同,则两元素的最高正价不一定相同
D.锂(Li)能在氧气中剧烈燃烧,产物是Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用标准0.1400molL﹣1NaOH溶液滴定未知浓度硫酸的实验操作如下 A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入酚酞.
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2﹣3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去NaOH溶液15.00mL.
(1)①滴定操作的正确顺序是(用序号填写);②在G操作中如何确定终点? .
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) .
(3)配制100mLNaOH标准溶液,必须使用到的玻璃仪器是
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值(选填“偏大”“偏小”或“无影响”)
(5)计算待测硫酸溶液的物质的量浓度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水.已知室温下1g甲硅烷自燃放出44.6kJ, 其热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=5的H2SO4的溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为( )
A. 1∶1 B. 1∶2 C. 1∶10 D. 1∶20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸参与热化学循环可通过二步循环或三步循环制取氢气,其中三步循环(碘硫热化学循环)原理如下图所示:

(1)“步骤Ⅰ.硫酸热分解”在恒容密闭容器中进行,测得各物质的物质的量分数与温度的关系如下图所示。其在650~1200℃间发生的主要反应的方程式为____。
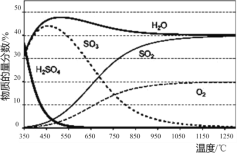
(2)“步骤Ⅱ.硫酸再生”的离子方程式为____(HI是强酸)。
(3)步骤Ⅲ的反应为2HI(g) ![]() H2(g) + I2(g) 。
H2(g) + I2(g) 。
①若在恒温恒容密闭容器中进行该反应,能说明已达到平衡状态的是___(填序号)。
a.容器内气体的总压强不再随时间而变化
b.n(HI)∶n(H2)∶n(I2)=2∶1∶1
c.反应速率:v(H2)正=v(H2)逆
d.I2(g)浓度不再随时间的变化而变化
②已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能。相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的![]() H为____kJ·mol-1。
H为____kJ·mol-1。
(4)将“三步循环”中步骤Ⅱ、Ⅲ用下图装置代替即为“二步循环”。
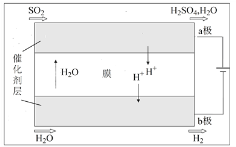
下列有关该装置的相关说法正确的是____(填序号)。
a.化学能转变为电能
b.催化剂可加快电极上电子的转移
c.反应的总方程式为SO2+2H2O ![]() H2+H2SO4
H2+H2SO4
d.每生成1molH2,电路中流过的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个试管中,过氧化氢分解产生氧气的反应速率最快的是 ( )
试管 | 温度 | 过氧化氢溶液浓度 | 催化剂 |
A | 常温 | 3% | — |
B | 常温 | 6% | — |
C | 水浴加热 | 3% | — |
D | 水浴加热 | 6% | MnO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要从乙酸的乙醇溶液中回收乙酸,合理的操作组合是
①蒸馏 ②过滤 ③静止分液 ④加足量钠 ⑤加入足量H2SO4 ⑥加入足量NaOH溶液 ⑦加入乙酸与浓H2SO4混合液后加热 ⑧加入浓溴水
A.⑦③B.⑧⑤②C.⑥①⑤②D.⑥①⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 2NO2(g)+ CH4(g)![]() N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=
N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=![]() ] ;下列说法不正确的是
] ;下列说法不正确的是

A. ΔH < 0
B. X > 2
C. 400K时,反应的平衡常数为5×10-2
D. 投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com