
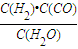 ,它所对应反应的化学方程式为______.
,它所对应反应的化学方程式为______. CH3OH(g)△H1=-90.7kJ?mol-1
CH3OH(g)△H1=-90.7kJ?mol-1 CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1 CO2(g)+H2(g)△H3=-41.2kJ?mol-1
CO2(g)+H2(g)△H3=-41.2kJ?mol-1
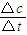 计算v(CO).
计算v(CO).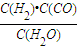 ,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g).催化反应室中温度小于830℃,升高温度反应③平衡向正反应移动,平衡常数增大.
,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据元素守恒,故另一反应物为固体C,反应中它所对应反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g).催化反应室中温度小于830℃,升高温度反应③平衡向正反应移动,平衡常数增大.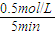 =0.1mol/(L?min);
=0.1mol/(L?min);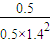 =
=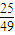 ,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L-2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以
,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L-2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以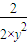 =
=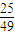


科目:高中化学 来源: 题型:阅读理解

| [H2][CO] |
| [H2O] |
| 容器编号 | n(C)mol | n(H2O)mol | n(CO)mol | n(H2)mol | v正、v逆比较 |
| Ⅰ | 0.2 | 0.12 | 1.20 | 0.20 | v正=v逆 |
| Ⅱ | 0.16 | 0.20 | 0.40 | 0.80 | v正 > > v逆 |
| 0.2×0.4 |
| 0.1 |
| 0.2×0.4 |
| 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| C(H2)C(CO) |
| C(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 .已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为
.已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| C(H2)?C(CO) |
| C(H2O) |
| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州市十校联考高三(上)期中化学试卷(解析版) 题型:填空题

 ,它所对应的化学反应为: .
,它所对应的化学反应为: .| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com