
已知下列反应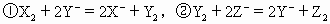
(1)将反应中具有氧化性的微粒按氧化性由强到弱的顺序排列________;
(2)将反应中具有还原性的微粒按还原性由强到弱的顺序排列________.
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| [NO]4[H2O]6 |
| [NH3]4[O2]5 |
| [NO]4[H2O]6 |
| [NH3]4[O2]5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 高温 |
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试 管中滴入几滴KSCN溶液. |
|
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com