
| A. | X、Y、Z的浓度不再变化 | |
| B. | 单位时间生成a mol X,同时生成3a mol Y | |
| C. | X、Y、Z的分子数比为1:3:2 | |
| D. | Z生成的速率与X生成的速率相等 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.X、Y、Z的浓度不再变化时,说明该反应正逆反应速率相等,反应达到平衡状态,故A正确;
B.无论反应是否达到平衡状态,都存在单位时间生成a mol X、同时生成3a mol Y,所以不能据此判断平衡状态,故B错误;
C.X、Y、Z的分子数比为1:3:2时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始浓度及转化率有关,所以不能据此判断平衡状态,故C错误;
D.当Z的生成速率与X的生成速率之比为2:1时该反应达到平衡状态,则Z生成的速率与X生成的速率相等时该反应没有达到平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态判断,为高频考点,化学平衡状态的本质特征是“正逆反应速率相等”,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti属于同种元素 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的质量数相同 | |
| C. | ${\;}_{22}^{48}$Ti的相对原子质量约为48 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为不同的核素,互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应为吸热反应 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 若此反应过程中有电子转移,可设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 解释或实验结论 |
| (1)纯净的A为无色粘稠液体, 易溶于水,沸点为380.4℃ | (1)将A从它的水溶液里分离出来 的操作方法是蒸馏. |
| (2)将13.6gA在20.0L纯O2(过量)中充分燃烧 并使反应后的气体依次缓缓通过浓硫酸和碱石灰后, 测得气体体积分别为17.76L和6.56L (所有气体体积均在标准状况下测定). | (2)A的实验式为C5H12O4, A的分子式为C5H12O4. |
(3)A的核磁共振氢谱如图: | (3)A中含有2种氢原 子,A的键线式为 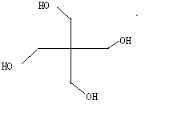 . . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
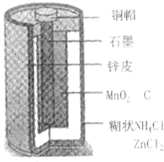 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 甲、乙氢氧化物溶液的碱性:甲>乙 | |
| C. | 乙能与盐酸反应放出H2,而甲不能 | |
| D. | 将甲、乙作电极组成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO32-的空间构型为平面三角形 | |
| B. | SiO2晶体中,最小的环上有6个Si原子和6个O原子 | |
| C. | CuSO4•5H2O中Cu的配位数为4 | |
| D. | SnBr2分子中Sn-Br的键角为120° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com