



 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通常用石油的年产量来衡量一个国家的石油化学工业发展水平 |
| B.酸雨的形成主要是汽车排出大量尾气 |
| C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
| D.二氧化碳在我国重点城市近年来已发布的“空气质量日报”中不列入首要污染物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
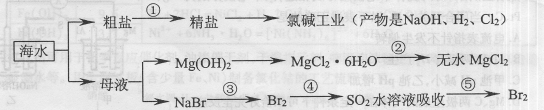
| A.在工段③和⑤中需要用到氯碱工业的产物 |
| B.工段②中的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.大量的含Fe3+废水排人海洋,易引发赤潮 |
| D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液一过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 | | |
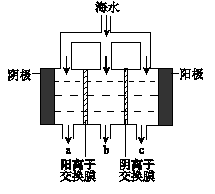
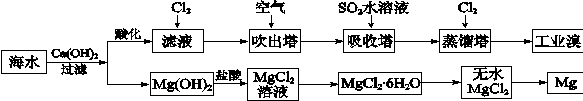
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
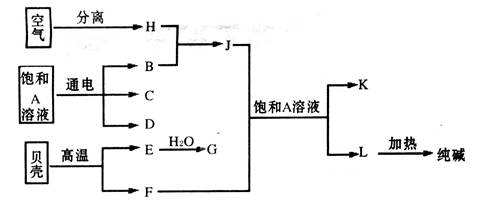

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1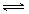 H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1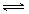 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2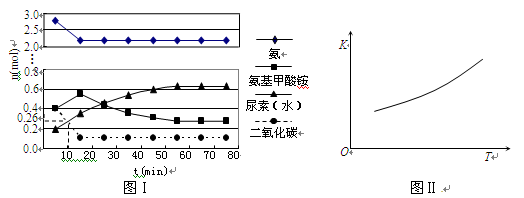
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 , 若A为溶液,则A可以是 。
, 若A为溶液,则A可以是 。 。
。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.光导纤维是以二氧化硅为主要原料制成的 |
| B.大气中二氧化碳的含量增加是酸雨的形成主要原因 |
| C.在西部和沿海地区兴建风力发电站,解决能源短缺问题 |
D.推广利用微生物发酵技术, 将植物桔杆、动物粪便等制成沼气以替代液化石油气符合“低碳经济” 将植物桔杆、动物粪便等制成沼气以替代液化石油气符合“低碳经济” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com