
【题目】对于反应Zn+H2SO4===ZnSO4+H2↑,下列叙述不正确的是

A. 反应过程中能量关系可用上图表示
B. 若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质
C. 若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下)
D. 若设计为原电池,负极有电流流入
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为测定某草酸晶体(H2C2O42H2O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO4溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO4溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A. 2.25 g B. 3.15 g C. 9.00 g D. 12.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为_______________________________。
(2)与CO互为等电子体的离子为_____(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于______(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 __________。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为__________。
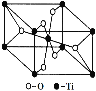
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是
A. Mg和Cu B. Na和Fe C. Al和Mg D. Zn和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
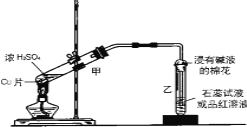
(1)写出甲装置中发生的主要反应的化学方程式____________________________。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是_________________________。
(3)生成的气体使品红溶液的颜色______________;实验完毕后,取少量乙试管中溶液于试管中加热,现象是________________;原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油分馏得到的轻汽油可在Pt催化下脱氢环化,逐步转化为芳香烃。以链烃A为原料合成两种高分子材料的路线如下:

已知以下信息:
①B的核磁共振氢谱中只有一组峰;G 为一氯代烃。
②R-x+R'-x![]() R-R'(x为卤素原子,R、R'为烃基)
R-R'(x为卤素原子,R、R'为烃基)
回答以下问题:
(1)H的化学名称为________,C 的官能团名称为________。
(2)J的结构简式为________,G生成H的反应类型为________ 。
(3)F合成丁苯橡胶的化学方程式为_________。
(4)I的同分异构体中能同时满足下列条件的共有________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体;
②既能发生银镜反应,又能发生水解反应。
其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是_________ (写出其中一种的结构简式)。
(5)参照上述合成路线,以2 -甲基已烷和一氯甲烷为原料(无机试剂任选),设计制备化合物E的合成路线: ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,有关试剂的保存方法错误的是( )
A. 烧碱溶液保存在带玻璃塞的试剂瓶中B. 液溴用水封保存
C. 少量金属钠保存在煤油中D. 浓硝酸保存在棕色细口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A是黄绿色气体、B、H是无色无味气体。(反应中生成的水已略去)

请回答以下问题:
(1)A是________,H是________。(填化学式)
(2)C物质在日常生活中可作________剂。
(3)F分子所含共价键类型是________;写出B的电子式_________。
(4)写出反应①的化学方程式:____________________________;写出反应③的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在生活和化学实验中有广泛应用。海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:

(1)步骤Ⅰ中,试剂甲必须具有的性质是________(填序号)。
A.碱性 B.稳定性 C.氧化性 D.还原性
(2)用惰性材料作电极,电解硫酸锰溶液制二氧化锰,写出阳极反应式:_____________________。步骤Ⅲ中,以KClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的KClO3溶液200 mL,该反应的离子方程式为____________________________________________。
(3)用100 mL 12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气在标准状况下体积范围为________________。工业上可以用实验室制氯气的残余物质溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的离子方程式:__________________。
(4)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案;
实验 | 20.0 mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
Ⅰ | 5% | 2.0 g | 20℃ | |
Ⅱ | 5% | 1.0 g | 20℃ | |
Ⅲ | 10% | 1.0 g | 20℃ | |
Ⅳ | ω | 2.0 g | 30℃ |
①实验Ⅱ和Ⅲ的结论是____________________________________________________。
②利用实验Ⅰ和Ⅳ探究温度对化学反应速率的影响,w=________。本实验待测数据是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com