
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的哑铃形![]() 的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )
的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )
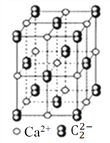
A. 1个Ca2+周围距离最近且等距离的![]() 数目为6
数目为6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4克CaC2晶体中含阴离子0.lmol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
科目:高中化学 来源: 题型:
【题目】下列氯化物中,既能跟金属和氯气直接反应制得,又能由盐酸和金属反应制得的是( )
A. CuCl2 B. MgCl2 C. FeCl2 D. AuCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等.
②沉淀I中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为___________。
(2)NaClO3在浸出液中发生的离子反应方程式为_________________。
(3)加入Na2CO3调PH至5.2,目的是__________________________;萃取剂层含锰元素,则沉淀II的主要成分为_____________。
(4)操作I包括:将水层加入浓盐酸调整PH为2~3,___________、____________、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是____________________(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为__。
[已知: CoC2O4·2H2O的摩尔质量为183g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲通过实验判断A、B、C三块金属的活动性,做了如下实验并得结论:当A与B组成原电池时,A 为电池的正极;当B与C组成原电池时,电流方向为由B到C,据此可知这三种金属的活动性强弱顺序为
A. A>B>C B. A>C>B C. C>B>A D. B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图,下列有关冰晶胞说法正确的是( )
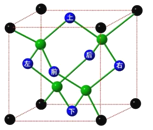
A. 冰晶胞内水分子间以共价键结合
B. 每个冰晶胞平均含有4个水分子
C. 水分子间的氢键具有方向性和饱和性,也是σ键的一种
D. 实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A. 工业制漂白粉:Cl2+2OH-===Cl-+ClO-+H2O
B. 将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO-
C. 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾有制药厂违反规定,购入工业用“二甘醇”代替医用丙二醇(C2H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇而死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,用途十分广泛。二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇和“二甘醇”及“乙二醇”的有关说法正确的是____________
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程I是石油加工中常用步骤,其名称为_______。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出实验室制备E的化学方程式___________,则为了能得到二甘醇D,物质B到物质C的反应条件是_________,该反应属于________(填反应类型)。写出B可能生成E的化学方程式______。
(4)反应Ⅲ的化学方程式为:____________。
(5)A的一种同系物结构简式为 请用系统命名法对其命名_______________。
请用系统命名法对其命名_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A. 澄清石灰水中通入过量的二氧化碳CO2+OH-===HCO![]()
B. 金属钠和水反应2Na+2H2O===2Na++2OH-+H2↑
C. 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2===2Fe3++O2↑+2H+
D. 三氧化硫与氯化钡溶液生成沉淀的反应SO3+Ba2++H2O===BaSO4↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量是高中化学中常用的物理量,请完成有关其内容的填空:
①15.6 gNa2X含有0.4molNa+,Na2X的摩尔质量为_____________,含X 3.2g的Na2X 的物质的量为_____________。
②硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol/L,硫酸根离子浓度 为0.75 mol/L,则K+的物质的量浓度为__________。
(2)有以下几种物质:①纯H2SO4,②硝酸钾溶液,③铜,④二氧化碳,⑤酒精,⑥碳酸氢钠固体,⑦蔗糖,⑧NaCl晶体,⑨氨水,⑩熔融KCl。
以上能导电的是________________________(填序号,下同);
以上属于电解质的是_________________;属于非电解质的是______________。
写出属于酸式盐的物质溶于水后的电离方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com