
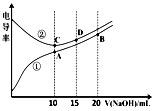
| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
分析 A.电解质溶液的电导率越大,导电能力越强,离子浓度越大,醋酸和盐酸的浓度相等,但c(H+)盐酸大于醋酸,未加NaOH溶液时盐酸电导率大于醋酸;
B.A点溶液中醋酸和NaOH恰好完全反应生成醋酸钠和水,溶液中存在电荷守恒c(CH3COO-)+c(OH-)-c(H+)=c(Na+);
C.相同温度下,酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
D.B点溶液中溶质为等物质的量浓度的NaOH和CH3COONa,NaOH完全电离,醋酸根离子部分水解.
解答 解:A.电解质溶液的电导率越大,导电能力越强,离子浓度越大,醋酸和盐酸的浓度相等,但c(H+)盐酸大于醋酸,未加NaOH溶液时盐酸电导率大于醋酸,所以曲线①代表滴定CH3COOH溶液的曲线,故A正确;
B.A点溶液中醋酸和NaOH恰好完全反应生成醋酸钠和水,溶液体积增大一倍,溶液浓度降为原来的一半,溶液中存在电荷守恒c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,故B正确;
C.相同温度下,酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,A中溶质为醋酸钠、B中溶质为物质的量浓度相等的醋酸钠和NaOH、C点溶质为氯化钠,A点促进水电离、B点抑制水电离、C点不影响水电离,所以A、B、C三点溶液中水电离的c(H+):B<C<A,故C错误;
D.B点溶液中溶质为等物质的量浓度的NaOH和CH3COONa,NaOH完全电离,醋酸根离子部分水解,溶液呈碱性,所以离子浓度大小顺序是c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析、判断能力,明确溶液中溶质成分及其性质、水电离影响因素等知识点是解本题关键,注意:B中因为体积增大一倍导致浓度降为原来的一半,很多同学往往忽略溶液体积变化而导致错误.


科目:高中化学 来源: 题型:选择题
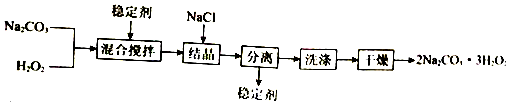
| A. | 可以用MnO2作稳定剂 | |
| B. | “结晶”时,加入NaCl的主要作用是增大产品的产率 | |
| C. | “分离”所用的主要玻璃仪器为烧杯、漏斗、玻璃棒 | |
| D. | 2Na2CO3•3H2O2受热分解属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )
如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )| A. | x可能表示该反应的平衡常数 | |
| B. | x可能表示平衡混合物的密度 | |
| C. | 当x表示Q的体积分数时,T2<T1 | |
| D. | 当x表示平衡混合物的物质的量时,T2<T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量Cl2充分反应,转移电子数为0.2×6.02×1023 | |
| B. | 由PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O可确定氧化性:PbO2>Cl2 | |
| C. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 常温下,用蒸馏水不断稀释0.1 mol•L-1醋酸,溶液中c(H+)/c(CH3COOH)的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
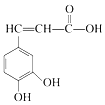
| A. | 与咖啡酸的物质类别完全相同(含咖啡酸),且苯环上只有3个取代基的同分异构体(包括顺反异构)有18种 | |
| B. | 1mol咖啡酸最多可与3molBr2反应 | |
| C. | 咖啡酸与 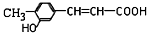 互为同系物 互为同系物 | |
| D. | 1mol咖啡酸与足量NaHCO3溶液反应产生3mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀为Mg(OH)2 | |
| B. | 在加入NaOH过程中生成沉淀最多为13.6g | |
| C. | 生成H2体积为5.6L | |
| D. | 刚加NaOH 溶液就有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com