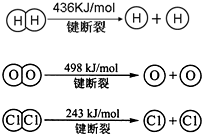
能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.
(1)已知:在25℃、101kPa下,1g甲醇燃烧生成CO
2和液态水时放热22.68kJ.请写出甲醇燃烧的热化学方程式.______
(2)目前有科学家在一定条件下利用水煤气(CO+H
2)合成甲醇:
CO(g)+2H
2(g)
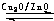
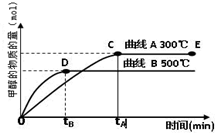
CH
3OH(g).甲醇的物质的量与反应温度的关系如图所示:
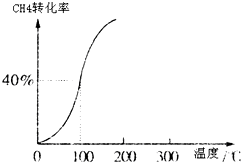
①合成甲醇反应的△H______0.(填“>”、“<”或“=”)
②其它条件不变,将E点的容积压缩到原来的1/2,正反应速率加快,逆反应速率______.(填“加快”、“减慢”、“不变”),重新平衡时c(CH
3OH)/c(CO)______.(填“增大”、“减小”或“不变”)
③230℃时,平衡常数K=1.若其它条件不变,将温度升高到450℃时,达到平衡时,K______1 (填“>、<或=”)
(3)、下列有关甲醇的说法正确的是______
A.甲醇能使蛋白质变性 B.甲醇能发生消去反应
C.甲醇不能被催化氧化 D.甲醇与钠反应比水与钠反应剧烈
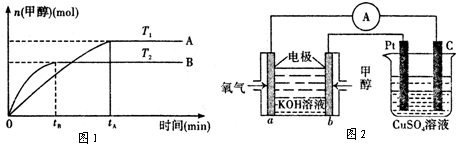
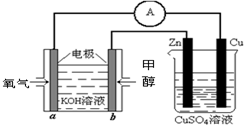
(4)利用甲醇燃料电池设计如图所示的装置:则该装置中Zn极为______极;写出a极的电极反应式______.

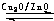



 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)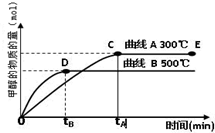 (2012?上饶一模)能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.
(2012?上饶一模)能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.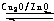 CH3OH(g).甲醇的物质的量与反应温度的关系如图所示:
CH3OH(g).甲醇的物质的量与反应温度的关系如图所示: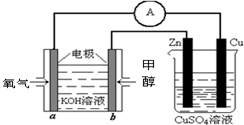
 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.