
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1 2SO3 ΔH=-196.6 kJ·mol-1 |
| B.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1 |
| C.H2(g)+Cl2(g)===HCl(g) ΔH=-92.5 kJ·mol-1 |
| D.H+(aq)+OH-(aq)===H2O(l) ΔH=+57.3 kJ |
科目:高中化学 来源:不详 题型:单选题
| A.由反应①可推知:CH4(g)+4NO2(g)= 4NO(g)+CO2 ( g ) +2H2O ( l) ;DH>-574 kJ/mol |
| B.反应①②转移的电子数相同 |
| C.若用标准状况下 4.48LCH4还原 NO2至 N2,设水为气态,则放出的热量为 1734kJ。 |
| D.若用标准状况下 4.48LCH4还原 NO2至 N2,则整个过程中转移的电子总数为1.60 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2A ( l ) + B (l ) =" 2C" (g )△H1 | B.2A ( g ) + B ( g ) =" 2C" (g )△H2 |
| C.2A ( g ) + B ( g ) =" 2C" ( l )△H3 | D.2A ( l ) + B ( l ) =" 2C" ( l )△H4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
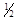 O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温下蒸发45g液态水需吸收____________kJ的热量。
O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温下蒸发45g液态水需吸收____________kJ的热量。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
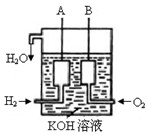
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1 = Q2 = Q3 | B.2Q3 = Q1 < Q2、 |
| C.Q3 < Q2 < Q1 | D.Q1 < Q2 < 3Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
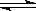 2SO3(g);△H =—Q1kJ/mol,在相同温度下,向密闭容器中通入4molSO2和1molO2,达到平衡时放出热量Q2 kJ,则下列关系式正确的是
2SO3(g);△H =—Q1kJ/mol,在相同温度下,向密闭容器中通入4molSO2和1molO2,达到平衡时放出热量Q2 kJ,则下列关系式正确的是| A. Q2=2Q1 | B. Q2<2Q1 | C. Q2=Q1 | D.Q2<Q1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com