
在含有Na2CO3和Na2SO4的溶液里加入足量的BaCl2溶液,生成43g沉淀。把沉淀用足量的盐酸处理,在标准状况下放出2.24升CO2气体,则原溶液中所含Na2CO3和Na2SO4 的物质的量的比值是多少?
1:1
【解析】
试题分析:解:刚开始的沉淀为BaCO3和BaSO4沉淀,加入足量的盐酸后,BaCO3溶解,设生成的BaCO3为x,即
BaCO3+2HCl=BaCl2+CO2↑+H2O
1 1
x 2.24/22.4=0.1mol
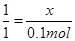 所以x=0.1mol,即BaCO3的质量n=0.1×197=19.7g,
所以x=0.1mol,即BaCO3的质量n=0.1×197=19.7g,
所以BaSO4的质量为43-19.7=23.3,
即Na2SO4的物质的量n=23.3/233=0.1mol,
Na2CO3的物质的量n=0.1mol,
所以Na2CO3和Na2SO4 的物质的量的比值=0.1:0.1=1:1
考点:利用化学方程式的简单计算,物质的量
点评:本题考查了利用化学方程式的简单计算,物质的量的计算,本题难度不大。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:福建省南安一中高一化学《物质的聚集状态》同步练习卷(带解析) 题型:计算题
在含有Na2CO3和Na2SO4的溶液里加入足量的BaCl2溶液,生成43g沉淀。把沉淀用足量的盐酸处理,在标准状况下放出2.24升CO2气体,则原溶液中所含Na2CO3和Na2SO4 的物质的量的比值是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com