
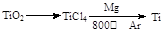
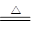 MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑ Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
 2MgO+C
2MgO+C 2MgO+C。(3) 金属镁的作用为作还原剂。在Ar气氛中的进行的理由是氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)。(4)①制备氮化镁(Mg3N2)要除去氧气和水蒸气的干扰,故连接顺序为a →( g )( f )→ ( d )( e )→( b )( c )→ h 。②通气后,应先点燃C装置的酒精灯确保把氧气除干净,装置A的作用是除去空气中的CO2。,装置E的作用是防止空气中的水蒸气进入与Mg3N2反应。 ③由于氮化镁与水反应后能放出氨气,可以通过检测氨气的生成来测定是否有氮化镁。方法为:取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
2MgO+C。(3) 金属镁的作用为作还原剂。在Ar气氛中的进行的理由是氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)。(4)①制备氮化镁(Mg3N2)要除去氧气和水蒸气的干扰,故连接顺序为a →( g )( f )→ ( d )( e )→( b )( c )→ h 。②通气后,应先点燃C装置的酒精灯确保把氧气除干净,装置A的作用是除去空气中的CO2。,装置E的作用是防止空气中的水蒸气进入与Mg3N2反应。 ③由于氮化镁与水反应后能放出氨气,可以通过检测氨气的生成来测定是否有氮化镁。方法为:取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。 

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:不详 题型:单选题
| A.物质的量之比为3:2 | B.质量之比为3:2 |
| C.摩尔质量之比为2:3 | D.反应速率之比为2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 甲同学 | 乙同学 |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | | |
| 化学方程式 | | A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
| 离子方程式 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。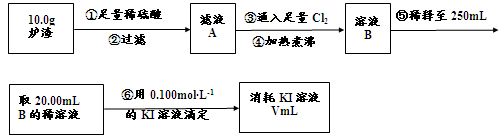
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
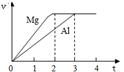
| A.上述由Mg和Al组成的混合物的质量为8g |
| B.硫酸的物质的量浓度为1 mol·L-1 |
| C.生成的H2在标准状况下的体积为11.2L |
| D.NaOH溶液的物质的量浓度为3.75 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
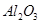 ,含
,含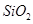 、
、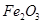 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: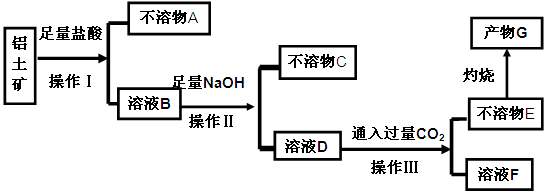
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | χ | 1.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
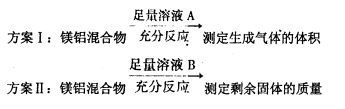
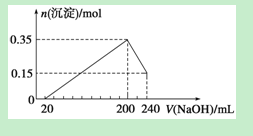
| A.溶液A选用NaOH溶液 |
| B.若溶液B选用浓硝酸,则测得镁的质量分数偏小 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com