
【题目】铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl22H20),为制取纯净的CuCl22H20,首先将其制成水溶液,然后按如图步骤进行提纯: 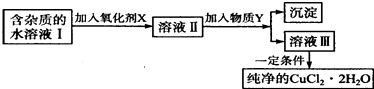
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
请回答下列问题.
(1)最适合作氧化剂X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物质Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ获得CuCl22H2O,需要经过、、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用(“酸式”或“碱式”)滴定管.反应的化学方程式: .
【答案】
(1)C
(2)AC
(3)蒸发浓缩;冷却结晶
(4)酸式;MnO4﹣+8H++5Fe2+=Mn2++5Fe3++4H2O
【解析】解:(1)根据实验目的,加入氧化剂的目的是将Fe2+氧化成Fe3+ , 便于生成Fe(OH)3沉淀而与Cu2+分离,K2Cr2O7、NaClO、H2O2、KMnO4都具有氧化性,能将亚铁离子氧化,但是K2Cr2O7、NaClO、KMnO4能引进新的杂质离子,双氧水是绿色氧化剂,得到的还原产物是水,不会引进杂质离子, 所以答案是:C;(2)加入的物质Y可调节,使Fe3+全部沉淀,同时不引进新杂质,铁离子在水中存在水解平衡:Fe3++3H2OFe(OH)3+3H+ , 用Cu(OH)2、CuCO3、CuO、Cu2(OH)2CO3等,
中和溶液的酸性,能促进水解平衡向正反应方向移动,调节pH,可以将铁离子沉淀(Fe3+氢氧化物完全沉淀时的PH:3.2),同时引入铜离子,无新的金属离子引入,且铜离子不沉淀(Cu2+氢氧化物开始沉淀时的PH:4.7),氢氧化钠和氨气都能使铜离子沉淀,无法分离Fe3+、Cu2+ ,
所以答案是:AC;(3)结晶水合物,为防止结晶水散失,从溶液中获得晶体通常采用降温结晶,所以从溶液中获得氯化铜晶体(CuCl22H20)要经过蒸发浓缩、冷却结晶、过滤三步操作,
所以答案是:蒸发浓缩;冷却结晶;(4)KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的胶管,所以选择酸式滴定管,测定溶液Ⅰ中Fe2+的浓度,用KMnO4标准溶液滴定,Fe2+与MnO4﹣反应,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子守恒、电荷守恒、原子守恒可知,离子反应为MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O,
所以答案是:酸式;MnO4﹣+8H++5Fe2+=Mn2++5Fe3++4H2O.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请根据如下实验方案回答问题. 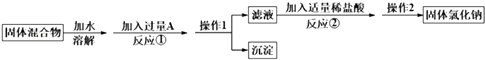
(1)A物质的化学式为;操作1的名称是 .
(2)反应①中加入略过量的A物质的目的是;判断A已过量的实验操作方法是 .
(3)写出反应②的化学方程式: . 如果加入盐酸过量,则对所得到的氯化钠的纯度(填“有”或“没有”)影响.
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则样品中NaCl的质量分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 ![]() 滴加
滴加 ![]() 白色沉淀滴加
白色沉淀滴加 ![]() 沉淀不溶解﹣→说明试样已变质
沉淀不溶解﹣→说明试样已变质
B.除去粗盐中硫酸钙杂质:粗盐 ![]() 足量
足量 ![]() 足量
足量 ![]() 溶液
溶液 ![]() 滤液中
滤液中 ![]() 盐酸
盐酸 ![]() 精盐
精盐
C.检验某溶液中是否含有Fe2+试样 ![]() 溶液颜色无变化
溶液颜色无变化 ![]() 溶液变红色﹣→溶液中含有Fe2+
溶液变红色﹣→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液30% ![]() 稀硝酸
稀硝酸 ![]() 溶液变蓝色﹣→氧化性:H2O2>I2
溶液变蓝色﹣→氧化性:H2O2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 聚乙烯制品既可以用作塑料薄膜,还可用作食品包装袋
B. 糖类、油脂、蛋白质都能发生水解反应
C. 油脂水解可得到丙三醇
D. 蛋白质在人体胃蛋白酶和胰蛋白酶的催化作用下,经过水解最终生成氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中几种常见有机物的说法,不正确的是( )
A.淀粉、纤维素不能互称同分异构体
B.油脂在碱性条件下的水解反应也称皂化反应
C.蛋白质可以在酶的催化下水解产生葡萄糖
D.交警用装有重铬酸钾(K2Cr2O7)的检测仪检验司机是否酒驾,乙醇表现还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的好似( )
A.已知2H2O(l)═2H2(g)+O2(g)△H=+571.6KJmol﹣1 , 无法求H2的燃烧热
B.已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性
C.已知500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出19.3KJ的热量,无法推出该反应的热化学方程式
D.已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2 , 无法得出△H2>△H1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为 2NO2(g,红棕色)+O3(g) ![]() N2O5(g,无色)+O2(g)。下列有关说法正确的是
N2O5(g,无色)+O2(g)。下列有关说法正确的是
A. 达到平衡时v正(NO2)∶v逆(N2O5)=1∶2
B. 达到平衡时,c(NO2)∶c(O3)∶c(N2O5)=2∶1∶1
C. 达到平衡时,v正=v逆=0
D. 达到平衡时,混合气体的颜色不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com