
【题目】蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(I)。合成化合物I的路线如下图所示:
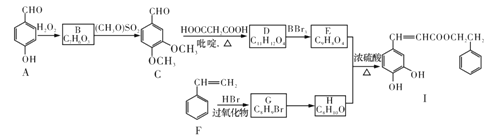
已知:①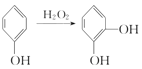
②RCHO+HOOCCH2COOH![]() RCH=CHCOOH
RCH=CHCOOH
请回答下列问题
(1)化合物A的名称是_____________;化合物I中官能团的名称是___________。
(2)G→H的反应类型是____________;D的结构简式是___________________。
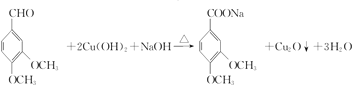
(3)写出化合物C与新制Cu(OH)2悬浊液反应的化学方程式_______________________。
(4)化合物W与E互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上只有3个取代基,则W可能的结构有__________________(不考虑顺反异构)种,其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积比为21:2:1:1:1:1,写出符合要求的W的结构简式:________________________________________________________。
(5)参照上述合成路线,设计由CH3CH—CH2和HOOCCH2COOH为原料制备CH2CH2CH= CHCOOH的合成路线(无机试剂及吡啶任选)。_________________________________。
【答案】对羟基苯甲醛 (酚)羟基、酯基、碳碳双键 取代反应 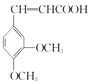
 11
11 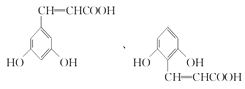
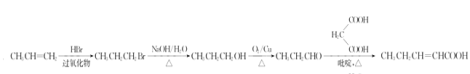
【解析】
由有机物的转化关系可知,![]() 发生信息①反应生成
发生信息①反应生成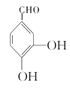 ,
, 与(CH3O)SO2发生取代反应生成
与(CH3O)SO2发生取代反应生成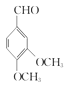 ,
, 与HOOCCH2COOH发生信息②反应生成
与HOOCCH2COOH发生信息②反应生成 ,则D为
,则D为 ;
; 在BBr3的作用下反应生成
在BBr3的作用下反应生成![]() ,则E为
,则E为![]() ;
;![]() 与HBr在过氧化物的作用下发生加成反应生成
与HBr在过氧化物的作用下发生加成反应生成![]() ,则G为
,则G为![]() ;
;![]() 在氢氧化钠溶液中共热发生水解反应生成
在氢氧化钠溶液中共热发生水解反应生成![]() ,则H为
,则H为![]() ;
;![]() 与
与![]() 在浓硫酸作用下共热发生酯化反应生成
在浓硫酸作用下共热发生酯化反应生成![]() 。
。
(1)化合物A的结构简式为![]() ,名称为对羟基苯甲醛;化合物I的结构简式为
,名称为对羟基苯甲醛;化合物I的结构简式为![]() ,官能为酚羟基、碳碳双键和酯基,故答案为:对羟基苯甲醛;酚羟基、碳碳双键和酯基;
,官能为酚羟基、碳碳双键和酯基,故答案为:对羟基苯甲醛;酚羟基、碳碳双键和酯基;
(2)G→H的反应为![]() 在氢氧化钠溶液中共热发生水解反应生成
在氢氧化钠溶液中共热发生水解反应生成![]() ;
; 与HOOCCH2COOH发生信息②反应生成
与HOOCCH2COOH发生信息②反应生成 ,则D为
,则D为 ,故答案为:取代反应;
,故答案为:取代反应; ;
;
(3)C的结构简式为 ,能与新制的氢氧化铜悬浊液共热发生氧化反应,反应的化学方程式为
,能与新制的氢氧化铜悬浊液共热发生氧化反应,反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(4)化合物W与E(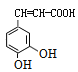 )互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上有3个取代基,三个取代基为-OH、-OH、-CH=CHCOOH,或者为-OH、-OH、-C(COOH)=CH2,2个-OH有邻、间、对3种位置结构,对应的另外取代基分别有2种、3种、1种位置结构(包含E),故W可能的结构有(2+3+1)×2-1=11种,其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积比为2:2:1:1:1:1,符合要求的W的结构简式为:
)互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上有3个取代基,三个取代基为-OH、-OH、-CH=CHCOOH,或者为-OH、-OH、-C(COOH)=CH2,2个-OH有邻、间、对3种位置结构,对应的另外取代基分别有2种、3种、1种位置结构(包含E),故W可能的结构有(2+3+1)×2-1=11种,其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积比为2:2:1:1:1:1,符合要求的W的结构简式为: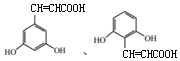 ,故答案为:11;
,故答案为:11; ;
;
(5)结合题给合成路线,制备CH3CH2CH= CHCOOH应用逆推法可知,CH3CH=CH2与HBr在过氧化物条件下反应生成CH3CH2CH2Br,然后碱性条件下水解生成CH3CH2CH2OH,再发生氧化反应生成CH3CH2CHO,最后与HOOCCH2COOH在吡啶、加热条件下反应得到CH3CH2CH=CHCOOH,合成路线流程图为: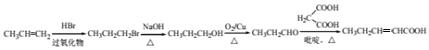 ,故答案为:
,故答案为: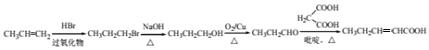 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于以下反应:A(s)+3B(g)![]() 2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
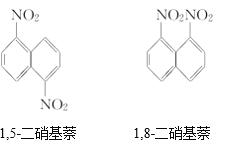
【题目】在一定条件下,萘可与浓硝酸、浓硫酸两种混酸反应生成二硝基化合物,它是1,5-二硝基萘和1,8-二硝基萘的混合物,后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这二种物质分离。在上述硝化产物中加入适量的98.3%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是
A. 对所得的滤液蒸发浓缩冷却结晶
B. 向滤液中缓缓加入水后过滤
C. 将滤液缓缓加入水中后过滤
D. 向滤液中缓缓加入Na2CO3溶液后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
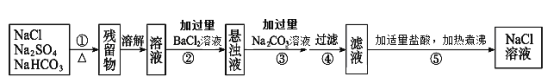
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学习小组设计了如下图所示的实验方案:
回答下列问题:
(1)操作①加热过程中,发生反应的化学方程式是_______。
(2)操作②不用Ba(NO3)2溶液的理由是:__________。
(3)进行操作②中,判断“BaCl2溶液是否过量”的方法是:_________。
(4)操作③“加入过量Na2CO3溶液”的目的是:________。
(5)操作⑤中“加适量盐酸”的主要目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)200mL2mol/L的Al2(SO4)3溶液中SO42-的物质的量浓度为___;
(2)标准状况下,36gH2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为___;
(3)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为___;
(4)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+=Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是

A.电源的X极为正极,Y极为负极
B.阴极的电极反应式为Fe2+-e-=Fe3+
C.阳极的电极反应式为H2O-e-=H++·OH
D.每消耗1molO2,整个电解池中理论上可产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
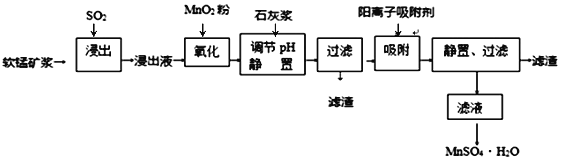
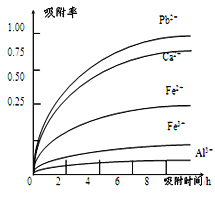
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。

(1)浸出过程中生成Mn2+反应的化学方程式为_________________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式___________________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有__________________________等(写二点)。
(5)吸附步骤除去的主要离子为_________________。
(6)电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_____。
(7)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列五种物质中①Ne;②H2O;③NH3;④KOH;⑤Na2O,只存在共价键的是____,只存在离子键的是____,既存在共价键又存在离子键的是____,不存在化学键的是_____.(填写序号)
(2)现有①Na2S、②NH4Cl、③干冰、④碘片四种物质,按下列要求回答:
用电子式表示①的形成过程是_______,用电子式表示④的形成过程是___________②的电子式是________③的电子式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___。
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃C)比MnS的熔点(1610℃)高,其主要原因是_________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
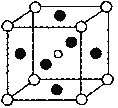
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置。
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com