
【题目】下列对有机物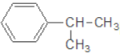 的叙述中,不正确的是( )
的叙述中,不正确的是( )
A.它难溶于水,但易溶于苯
B.它会使酸性高锰酸钾溶液褪色
C.该物质含苯环的同分异构体(不包括它本身)共有5种
D.一定条件下可以和浓硝酸、浓硫酸的混合物发生硝化反应
【答案】C
【解析】
分析题给信息,该有机物为苯的同系物,能发生取代、加成、燃烧等反应,并且能被酸性高锰酸钾氧化为苯甲酸而使酸性高锰酸钾溶液褪色。据此进行分析。
A. 和苯都是非极性溶剂,水是极性溶剂,根据相似相溶原理,
和苯都是非极性溶剂,水是极性溶剂,根据相似相溶原理, 易溶于苯,难溶于水,A项正确;
易溶于苯,难溶于水,A项正确;
B. 中与苯环直接相连的碳上有氢原子,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,B项正确;
中与苯环直接相连的碳上有氢原子,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,B项正确;
C.该物质含苯环的同分异构体(不包括它本身)有:正丙苯、邻甲基乙苯、间甲基乙苯、对甲基乙苯、1,2,3,-三甲苯、1,2,4,-三甲苯以及均三甲苯,共7种,C项错误;
D. 分子中含有苯环,和苯的化学性质类似,也能发生硝化反应,D项正确;
分子中含有苯环,和苯的化学性质类似,也能发生硝化反应,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
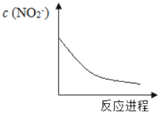
A.随着反应的进行,溶液中的H+浓度减小B.反应的氧化剂是NO3-
C.消耗1 mol氧化剂,转移电子6NAD.氧化性:Cr2O72->NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
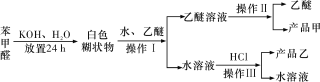
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照如图所示的操作步骤,完成铝与盐酸反应的实验。
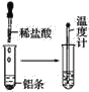
回答下列问题:
(1)实验过程中观察到的实验现象是__。
(2)写出铝与盐酸反应的离子方程式__。
(3)该反应是放热反应还是吸热反应__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的分子式为________;
(2)D中含有的官能团是________,分子中最多有________个碳原子共平面;
(3)①的反应类型是________,③的反应类型是________;
(4)⑤的化学方程式为________;
(5)B的同分异构体中能同时满足如下条件:a.苯环上有两个取代基,b.能发生银镜反应,共有______种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6∶2∶2∶1∶1的是________(写结构简式);
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:___。(其他试剂任用)(合成路线常用的表示方法:起始原料A
的合成路线:___。(其他试剂任用)(合成路线常用的表示方法:起始原料A![]() B……
B……![]() 目标产物)。
目标产物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康。
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用的流程如下图所示:
![]()
Na2S2O3在此过程中表现________性。若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为_________价,反应的离子方程式为______________________。
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车。其反应原理如下,请配平该反应方程式:
(_____)CrO3 +(_____)CH3CH2OH +(_____)H2SO4 —(_____)CH3CHO + (_____)Cr2(SO4)3+(_____)H2O
(3)已知存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
已知Ksp(BaCrO4)=1.25×10-10;Ksp(PbCrO4)=2.75×10-13;
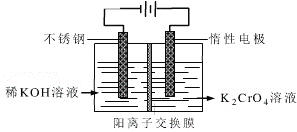
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过)。通电后阳极的电极反应式为____________________。请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。
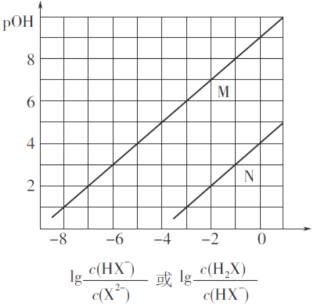
下列叙述正确的是
A. 曲线N表示pOH与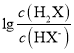 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com