
100 mL 6 mol·L-1的硫酸溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,又不影响生成氢气的总量,可向反应物中加入适量的( )
| A.Na2CO3固体 | B.3 mol·L-1的H2SO4溶液 |
| C.CH3COOK溶液 | D.KNO3溶液 |
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 |
| B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| C.一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 |
| D.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碳酸铵[(NH4)2CO3]室温下能自发地分解产生氨气,对其说法正确的是( )
| A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大 |
| B.碳酸铵分解是因为外界给予了能量 |
| C.该反应的ΔH-TΔS>0 |
| D.碳酸盐都不稳定,都能自发分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
纳米是长度单位,1纳米等于1×10-9 m,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的金属性强,反应时反应速率快 |
| B.常温下“纳米铜”比铜片更易失电子,反应时反应速率快 |
| C.常温下“纳米铜”的还原性大于铜片的还原性 |
| D.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应:A+3B 2C+D,在某一段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
2C+D,在某一段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
| A.0.5 mol·L-1·min-1 | B.1 mol·L-1·min-1 |
| C.2 mol·L-1·min-1 | D.3 mol·L-1·min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒容密闭器中通入物质的量浓度均0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是( )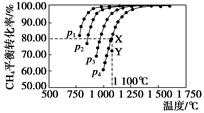
| A.上述反应的ΔH>0 |
| B.压强p1>p2>p3>p4 |
| C.1 100 ℃该反应的平衡常数为64 |
| D.压强为p4时,在Y点:v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2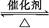 2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
| A.等于1.6 mol | B.等于1.2 mol | C.大于1.6 mol | D.小于1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在2NO2(红棕色) N2O4(无色)的可逆反应中,下列状态一定属于平衡状态的是( )。
N2O4(无色)的可逆反应中,下列状态一定属于平衡状态的是( )。
| A.N2O4和NO2的分子数比为1∶2 |
| B.N2O4和NO2的浓度相等 |
| C.平衡体系的颜色不再改变 |
| D.单位时间内有1 mol N2O4变为NO2的同时,有1 mol NO2变为N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g) Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是 ( )
Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是 ( )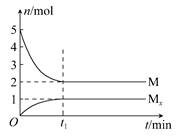
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时,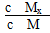 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com