
| ||
| ||
| ||
| 0.672L |
| 22.4L/mol |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
(10分)洪灾过后,饮用水的杀菌消毒成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;

![]() (2)实验室常用软锰矿(主要成分为MnO2)和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓) MnCl2+Cl2 ↑ + 2H2O,其中,氧化产物是 (填化学式),氧化剂与还原剂的物质的量之比为 ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子 mol 。
(2)实验室常用软锰矿(主要成分为MnO2)和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓) MnCl2+Cl2 ↑ + 2H2O,其中,氧化产物是 (填化学式),氧化剂与还原剂的物质的量之比为 ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子 mol 。
(3)检验Cl2已集满的方法: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南省岳阳一中高一上学期期末考试化学试卷 题型:填空题
(10分)洪灾过后,饮用水的杀菌消毒成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
(2)实验室常用软锰矿(主要成分为MnO2) 和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)
和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)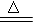 MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是 (填化学式),氧化剂与还原剂的物质的量之比为 ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子 mol 。
MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是 (填化学式),氧化剂与还原剂的物质的量之比为 ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子 mol 。
(3)检验Cl2已集满的方法: 。
查看答案和解析>>
科目:高中化学 来源:2014届湖南省高一上学期期末考试化学试卷 题型:填空题
(10分)洪灾过后,饮用水的杀菌消毒成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;

 (2)实验室常用软锰矿(主要成分为MnO2)和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2 ↑ + 2H2O,其中,氧化产物是 (填化学式),氧化剂与还原剂的物质的量之比为 ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子 mol 。
(2)实验室常用软锰矿(主要成分为MnO2)和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2 ↑ + 2H2O,其中,氧化产物是 (填化学式),氧化剂与还原剂的物质的量之比为 ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子 mol 。
(3)检验Cl2已集满的方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 MnCl2+Cl2+2H2O,其中,氧化产物是______(填化学式),氧化剂与还原剂的物质的量之比为______,若生成的Cl2在标准状况下的体积为672ml,则转移电子______ mol.
MnCl2+Cl2+2H2O,其中,氧化产物是______(填化学式),氧化剂与还原剂的物质的量之比为______,若生成的Cl2在标准状况下的体积为672ml,则转移电子______ mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com