实验室常用浓HCl与MnO2的反应制取少量的氯气,其化学方程式为MnO2+4HCl=MnCl2+Cl2↑+2H2O取一定量的浓盐酸与二氧化锰发生反应,产生的氯气在标况下的体积为11.2L.则反应中的氧化剂为 (填化学式),质量为 ;还原剂为 (填化学式),物质的量为 ;转移电子的数目为 .
【答案】
分析:MnO
2+4HCl=MnCl
2+Cl
2↑+2H
2O中,Mn元素的化合价降低,Cl元素的化合价升高,利用MnO
2~2HCl~Cl
2↑~2e
-进行相关计算.
解答:解:产生的氯气在标况下的体积为11.2L,其物质的量为
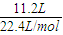
=0.5mol,
MnO
2+4HCl=MnCl
2+Cl
2↑+2H
2O中,Mn元素的化合价降低,则MnO
2为氧化剂,由MnO
2~Cl
2↑可知,其质量为0.5mol×87g/mol=43.5g,
Cl元素的化合价升高,则HCl为还原剂,由2HCl~Cl
2↑可知,还原剂的物质的量为0.5mol×2=1mol,
由Cl
2↑~2e
-可知,转移电子数目0.5mol×2×N
A=N
A个,
故答案为:MnO
2;43.5g;HCl;1mol;N
A.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化及氧化还原反应中的基本概念即可解答,注意HCl的作用为解答的易错点,题目难度不大.

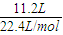 =0.5mol,
=0.5mol,
