

| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
分析 (1)根据X的构造写出其名称,结合实验原理判断Y的作用;
(2)实验室中用氯化铵和氢氧化钙固体制取氧气,据此书写出反应方程式;
(3)高温下H2O2分解,会影响实验结果;根据装置中的物质以及性质结合产物来书写方程式;
(4)①根据140℃时完全脱水,杂质受热不分解,结合样品总质量计算出结晶水的总质量、物质的量,从而得出样品中CaO2•8H2O物质的量,再根据60℃时固体的质量计算出失去结晶水的质量、物质的量,从而得出失去结晶水的数目,再计算出CaO2•xH2O中的x;
②根据①计算出的样品中CaO2的物质的量及=nM计算出其质量,再计算出样品中CaO2•8H2O的纯度;
(5)①高锰酸钾未过量前,溶液是无色的,当溶液变成浅红色,且半分钟不褪色,滴定结束;
②三次消耗的高锰酸钾溶液的体积分别是:23.02mL、23.03mL、23.04mL,平均体积为23.03mL;再根据关系式5(CaO2•8H2O)~5H2O2~2KMnO4计算出过氧化钙晶体的物质的量,最后求出过氧化钙晶体的质量分数.
解答 解:(1)根据X的构造可知X为分液漏斗;X为长颈漏斗,在该装置中可以防倒吸,故答案为:分液漏斗;防倒吸;
(2)实验室中用氯化铵和氢氧化钙固体制取氧气,反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)由于低于0℃,液体易冻结,反应困难,而温度较高,过氧化氢分解速率加快,所以制取CaO2•8H2O一般在0℃~5℃的低温下进行;根据装置C中的物质得出制取的原理方程式为:CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O,
故答案为:低于0℃,液体易冻结,反应困难,温度较高,过氧化氢分解速率加快;CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O;
(4)①140℃时完全脱水,杂质受热不分解,则样品中CaO2•8H2O含有的结晶水的总质量为:2.76g-1.32g=1.44g,结晶水的物质的量为:$\frac{1.44g}{18g/mol}$=0.08mol,
60℃时固体的质量为1.68g,失去结晶水的质量为:2.76g-1.68g=1.08g,失去结晶水的物质的量为:$\frac{1.08g}{18g/mol}$=0.06mol,原样品中含有CaO2•8H2O的物质的量为:$\frac{0.08mol}{8}$=0.01mol,
所以60℃时失去结晶水的个数为:$\frac{0.06mol}{0.01mol}$=6,故60℃时CaO2•xH2O中x=8-6=2,
故答案为:2;
②根据①可知CaO2•8H2O的物质的量为0.01mol,则CaO2的物质的量也是0.01mol,其质量为:72g/mol×0.01mol=0.72g,样品中CaO2的纯度为:$\frac{0.72g}{2.76g}$×100%≈26.09%,
故答案为:26.09%;
(5)①滴定终点观察到的现象为:当滴入最后一滴KMnO4标准溶液后溶液由无色变浅红色,且30s不褪色;
故答案为:当滴入最后一滴KMnO4标准溶液后,溶液由无色变浅红色,且30s不褪色;
(4)、高锰酸钾溶液消耗的体积分别是:23.02mL、23.03mL、23.04mL,平均体积为:$\frac{23.02mL+23.03mL+23.04mL}{3}$=23.03mL,
根据关系式 5(CaO2•8H2O)~5H2O2~2KMnO4
n(CaO2•8H2O)=$\frac{5}{2}$n(KMnO4)=$\frac{5}{2}$×0.0200 mol•L-1×23.03mL×10-3L•mL-1=1.151×10-3 mol,
CaO2•8H2O的质量分数为:$\frac{1.151×1{0}^{-3}mol×216g/mol}{0.3000g}$×100%=82.91%,
故答案为:根据关系式 5(CaO2•8H2O)~5H2O2~2KMnO4
n(CaO2•8H2O)=$\frac{5}{2}$n(KMnO4)=$\frac{5}{2}$×0.0200 mol•L-1×23.03mL×10-3L•mL-1=1.151×10-3 mol,
CaO2•8H2O的质量分数为:$\frac{1.151×1{0}^{-3}mol×216g/mol}{0.3000g}$×100%=82.91%.
点评 本题考查了性质实验方案的设计、中和滴定的计算等知识,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力,明确实验目的及原理为解答关键,(4)为易错点,需要正确分析图象曲线变化的含义.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用如图实数装置进行中加热测定实验,请回答下列问题:
用如图实数装置进行中加热测定实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.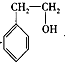 +CH3COOH$?_{△}^{浓硫酸}$
+CH3COOH$?_{△}^{浓硫酸}$ +H2O.
+H2O. 、、
、、 、
、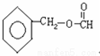 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com