
【题目】![]() 时,向容积为2L的恒容密闭容器中充入一定量的CO和
时,向容积为2L的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() 。反应过程中测定的部分数据见下表:
。反应过程中测定的部分数据见下表:
反应时间 |
|
|
0 |
|
|
20 |
|
|
30 |
|
|
下列说法正确的是
A.反应在![]() 内的平均速率为
内的平均速率为![]()
B.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() 、
、![]() 、
、![]() ,达到新平衡前
,达到新平衡前![]() 正
正![]() 逆
逆![]()
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】元素的基态原子的核外电子有3种能量状态、5种空间状态,X是其中第一电离能最小的元素;元素Y的M层电子运动状态与X的价电子运动状态相同;元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子。
(1)X基态原子的电子排布式为___________。
(2)X的氢化物(H2X)在乙醇中的溶解度大于H2Y,其原因是___________。
(3)在Y的氢化物(H2Y分子中,Y原子轨道的杂化类型是___________。
(4)Y与X可形成YX32-。
①YX32-的立体构型为___________(用文字描述)。
②写出一种与YX32-互为等电子体的分子的化学式___________。
(5)Z的氯化物与氨水反应可形成配合物[Z(NH3)4(H2O)2]Cl2,该配合物加热时,首先失去配离子中的配体是___________(写化学式)。

(6)Y与Z所形成化合物晶体的晶胞如图所示,该化合物的化学式为___________。其晶胞边长为540.0pm,密度为___________g·cm-3(列式并计算),a位置Y与b位置Z之间的距离为___________pm(列式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,容器A、B的容积相等,K为开关,活塞可以左右移动。一定温度下,关闭K,向容器A中通入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)ΔH<0。则下列说法不正确的是( )
N2O4(g)ΔH<0。则下列说法不正确的是( )

A.保持活塞位置不变,打开K,体系中气体的颜色先变浅,然后略加深
B.打开K,一段时间后再关闭K,向右推动活塞,最终容器A中气体的颜色比容器B中的浅
C.保持活塞位置不变,打开K,一段时间后再关闭K,加热容器A,容器A中气体的颜色比容器B中的深
D.打开K,一段时间后再关闭K,向容器B中通入氩气,容器B中气体的颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:

下列说法正确的是
A. 该反应的△H<O
B. X 点CH4的转化率为20%
C. X点与Y点容器内压强比为55:51
D. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1mol 时V(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与
与![]() 催化重整反应为
催化重整反应为![]()
![]() 。现向
。现向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,不同温度下平衡体系中
进行催化重整反应,不同温度下平衡体系中![]() 和CO的体积分数
和CO的体积分数![]() 随温度变化如下表所示:
随温度变化如下表所示:
体积分数 温度 |
|
|
| a | a |
| c | b |
测得:![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
A.![]() 大于
大于![]()
B.![]() 时该反应的平衡常数为
时该反应的平衡常数为![]()
C.![]() 时向
时向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,达到平衡时,
进行催化重整反应,达到平衡时,![]() 为
为![]()
D.![]() 时向
时向![]() 恒容密闭容器中充入等物质的量
恒容密闭容器中充入等物质的量![]() 、
、![]() 、CO、
、CO、![]() 进行催化重整反应,此时反应可能正向移动
进行催化重整反应,此时反应可能正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )


A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有 0.1 mol/L 的四种溶液:①HCl ②CH3COOH ③NaOH ④Na2CO3
(1)用化学用语解释溶液①呈酸性的原因:_________。
(2)溶液③的 pH=_________。
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①_________②(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:_________。
(5)常温下,下列关于溶液②的判断正确的是_________。
a.c(CH3COO) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO) > c(OH )
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示:
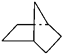
(1)写出其分子式____________。
(2)当降冰片烷发生一氯取代时,能生成_____________种沸点不同的产物。
(3)根据降冰片烷的键线式结构,请你判断:降冰片烷属于______________________。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是__________________。
a.能溶于水 b.能燃烧 c.能使酸性高锰酸钾溶液褪色
d.能发生加成反应 e. 能发生取代反应 f. 常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,用石墨电极电解饱和食盐水。下列说法不正确的是( )
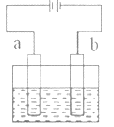
A.通电使NaCl 发生电离
B.电极a 是阳极
C.Na+向 b 极移动
D.a 极产生黄绿色气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com