
(12分) 回答下列问题:

(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 和将空气与碳反应后除去CO 2;氢气的来源是用水和碳氢化合物反应并产生CO, 写出采用天然气为原料制取氢气的化学反应方程式 。
(2)设备A中含有电加热器、触煤和热交换器,设备A中发生的化学反应方程式为 ;
(3) 设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)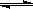 CO2 (g)+ H2
(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
CO2 (g)+ H2
(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
(计算结果保留三位有效数字)
(1)先加压液化再分馏(蒸馏) (2分); CH4+H2O CO+3H2 (2分)
CO+3H2 (2分)
(2) N2(g)+3H2(g) 2NH3 (2分)
2NH3 (2分)
(3)冷却塔(或冷凝器) (1分) n (1分)
(4)将液氨与未反应的原料气分离(2分)
(5)13.8(2分)
【解析】
试题分析:(1)分离两种气体的方法是先加压液化再分馏。利用天然气制备氢气则需甲烷和水反应,条件是催化剂。(2)A为反应室,装置提供高温催化剂的反应条件,即为氮气与氢气反应制备氨气的反应。(3)C后接液氨储存,C中需将液氨分离出来,所以B为冷却塔,为加大冷却效率,装置设计了很多回型管道。(4)将液氨与其他物质分离开。(5)设CO、H2O起始浓度为x、ymol/L,则转化的CO的最小值为0.9x。
CO(g)+H2O(g) = CO2(g)+H2(g)
起始 x y 0 0
变化 0.9x 0.9x 0.9x 0.9x
平衡 0.9x y-0.9x 0.9x 0.9x?
根据平衡常数列式:(0.9x)2/0.1x(y-0.9x)=0.627?解得?y/x=13.8。所以只要此值大于13.8,转化率就会超过90%。
考点:工业合成氨的反应及化学反应平衡原理,平衡常数的计算。
点评:此题以合成氨反应为载体?综合考查了化学与技术模块的主干知识。


科目:高中化学 来源: 题型:
| cVM |
| 1000w |
| cVM |
| 10w |
| cVM |
| 1000w |
| cVM |
| 10w |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2/Cu |
| △ |
| O2 |
| △ |
| H2O/NaOH |
| △ |

| 催化剂 |
| 催化剂 |
| 浓硫酸 |
| △ |
 +2H2O
+2H2O| 浓硫酸 |
| △ |
 +2H2O
+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com