
【题目】I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:______________,反应类型:________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:______________________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
III.已知乙烯能发生以下转化:

(1)C中含官能团名称_________;
(2)写出B与D反应的化学方程式____________________________;反应类型:________。
(3)写出反应③的化学方程式:____________________,列举聚乙烯的一种用途_______。
【答案】 C4H10 CH3CH2CH2CH3、CH3CH(CH3)2 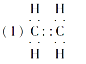
![]() CH2=CH—CH3+Br2
CH2=CH—CH3+Br2![]() CH2Br—CHBr—CH3 加成反应 下层无色,上层紫红色
CH2Br—CHBr—CH3 加成反应 下层无色,上层紫红色 ![]() 取代反应 A>B 醛基 CH3COOH + CH3CH2OH
取代反应 A>B 醛基 CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 +H2O 酯化反应或取代反应
CH3COOCH2CH3 +H2O 酯化反应或取代反应 ![]() 制塑料
制塑料
【解析】I .烷烃中碳原子数目≤3的烷烃不存在同分异构体现象,即CH4、C2H6、C3H8都无同分异构体,从丁烷开始才出现同分异构体,C4H10既可表示正丁烷(CH3CH2CH2CH3),也可表示异丁烷(CH3CH(CH3)2);
II.(1)A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液态烃,B仅由碳氢两种元素组成,因碳元素与氢元素的质量比为12:1,求得碳氢元素的个数比为1:1,即化学式CxHx,B的相对分子质量为78.得12x+1x=78,x=6,故B的分子式为C6H6,所以B为苯,则:A的电子式为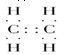 ,B的结构简式为:
,B的结构简式为:![]() 或
或![]() ;
;
(2)A相邻的同系物C为CH2=CHCH3,使溴水褪色发生加成反应,该反应为:CH2=CHCH3+Br2→CH2BrCHBrCH3;
(3)碘水中加入苯发生萃取,苯的密度比水的小,则苯在上层,观察到下层无色,上层紫红色;
(4)B与浓H2SO4与浓HNO3在50-60℃反应的化学反应方程为:![]() ,属于取代反应;
,属于取代反应;
(5)乙烯中H元素质量分数比苯中H元素质量分数大,故相同质量的乙烯、苯燃烧,乙烯消耗的氧气更多,即等质量的A、B完全燃烧时消耗O2的物质的量A>B;
III.根据图可知:B为乙醇,C为乙醛,D为乙酸,
(1)C为乙醛CH3CHO,乙醛中含有的官能团为醛基;
(2)B为乙醇,D为乙酸,乙醇和乙酸通过酯化反应生成乙酸乙酯,化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(3)反应③为乙烯的加聚反应,反应方程式为![]() ;生成的聚乙烯可用来制塑料。
;生成的聚乙烯可用来制塑料。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,体积均为0.25 L的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,达到平衡。下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,达到平衡。下列说法正确的是( )
容器编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
N2 | H2 | NH3 | NH3 | ||
① | 500 | 1 | 3 | 0 | 0.5 |
② | 500 | 0.6 | 1.8 | 0 | |
③ | 550 | 0 | 0 | 2 | a |
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,容器②中H2的转化率大于25%
C. a<0.5
D. 起始时向容器①中充入1 mol N2、2 mol H2、0.5 mol NH3,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2CNa2S+2CO2↑。其主要流程如下:
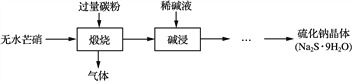
(1) 上述流程中采用稀碱液比用热水更好,理由是________________________________________________________________________。
(2) 已知:I2+2S2O32-===2I-+S4O62-。所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1 I2溶液滴定至终点,用去5.00 mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为____________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数,写出计算过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. (CH3)2C=CHCH2CH3中所有碳原子共面
B. 苯不能使酸性高锰酸钾溶液褪色,证明苯分子中不存在单双键交替的结构
C. 聚乙烯能使溴水褪色
D. 甲醇、乙二醇(HOCH2CH2OH)互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于吸热反应的说法,正确的是
A.凡需加热的反应一定是吸热反应 B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应 D.酸碱中和反应的逆反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是
X | Y | Z | |
W | Q | M |
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为![]() 其二氢取代物有两种
其二氢取代物有两种
C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析不正确的是 ( )
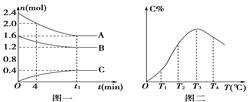
A. 该反应的平衡常数表达式为: 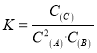
B. 0~4 min时,A的平均反应速率为0.01 mol/(L·min)
C. 由T1向T2变化时,v正>v逆
D. 平衡后升高温度,K值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com