
���и���仯�У���ѧ��Ӧ�������仯����H��Q��ǰ��С�ں��ߵ�һ���ǣ�������
��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H1��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H2
��2H2��g��+O2��g���T2H2O��l����H1��H2��g��+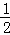 O2��g���TH2O��l����H2
O2��g���TH2O��l����H2
��t��ʱ����һ�������£���1mol SO2��1mol O2�ֱ����ں��ݺͺ�ѹ�������ܱ������У��ﵽƽ��״̬ʱ�ų��������ֱ�
ΪQ1��Q2
��CaCO3��s���TCaO��s��+CO2��g����H1��CaO��s��+H2O��l���TCa��OH��2��s����H2��
| �� | A�� | �٢ڢ� | B�� | �ڢ� | C�� | �ڢۢ� | D�� | �ۢ� |
| ��Ӧ�Ⱥ��ʱ䣮. | |
| ר�⣺ | ��ѧ��Ӧ�е������仯�� |
| ������ | �ټ���ȼ������Һ��ˮ���ȴ��ڼ��鷴Ӧ��������ˮ���ʱ�������űȽϣ� ��������������Ӧ��ͬ����������ͬ��Ӧ�Ȳ�ͬ�� �ۺ��������з�Ӧ���й�����ѹǿ��С����ѹ�����з�Ӧ������ѹǿ�Ⱥ��������д�Ӧ��ת���ʴ� ��̼������ȣ������ƺ�ˮ��Ӧ���ȣ��ʱ�������űȽϣ� |
| ��� | �⣺�ټ���ȼ������Һ��ˮ���ȴ��ڼ��鷴Ӧ��������ˮ���ʱ�������űȽϣ���H1����H2 ��������������Ӧ��ͬ����������ͬ��Ӧ�Ȳ�ͬ���ʱ�������űȽϡ�H1����H2 �ۺ��������з�Ӧ���й�����ѹǿ��С����ѹ�����з�Ӧ������ѹǿ�Ⱥ��������д�Ӧ��ת���ʴ�H1����H2 ��̼������ȣ������ƺ�ˮ��Ӧ���ȣ��ʱ�������űȽϣ���H1����H2 �����������٢ڢ۷��ϣ� ��ѡA�� |
| ������ | ���⿼���˷�Ӧ�ʱ�ıȽϣ���Ӧ���̷�������Ӧ��������״̬���жϣ�����״̬��ͬ��Ӧ�����仯��ͬ������ͬ��Ӧ�����仯��ͬ����Ŀ�Ѷ��еȣ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������������ɢϵ�ı��������� �� ��
A������ķ�ɢ����ͨ����ֽ��϶������Һ�ķ�ɢ�ʲ���
B���������������
C����ɢ������ֱ����1nm��100nm֮��
D��������һ�����������ȶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������£����淴ӦX(g)+3Y(g) 2Z(g),��X��Y��Z��ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ0)��ƽ��ʱX��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��0.08 mol��L��1���������жϲ��������ǣ� ��
2Z(g),��X��Y��Z��ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ0)��ƽ��ʱX��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��0.08 mol��L��1���������жϲ��������ǣ� ��
A.c1��c2=1��3 B.ƽ��ʱ��Y��Z����������֮��Ϊ3��2
C.X��Y��ת���ʲ���� D.c1��ȡֵ��ΧΪ0��c1��0.14 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ܱ������зֱ����HCl��H2S��O2�������壬�����ǵ��¶Ⱥ��ܶȶ���ͬʱ�������������ѹǿ��P���Ӵ�С��˳���ǣ� ��
A��P(HCl) >P(H2S)>P(O2) B��P(O2)> P(H2S) > P(HCl)
C��P(H2S)>P(HCl)>P(O2) D��P(H2S)>P(O2)>P(HCl)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���к�NaCl��Na2SO4��NaNO3�Ļ���ѡ���ʵ����Լ�����ת��Ϊ��Ӧ�ij�������壬�Ӷ�ʵ��Cl-��SO42-����NO3-������롣��Ӧ��ʵ����̿�����ͼ��ʾ��
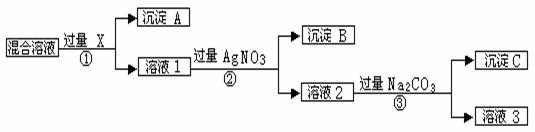
��ش��������⣺
��д��ʵ���������������ʵĻ�ѧʽ�� �Լ�X �� ������A�� ������B�� ��
������ʵ�������м��������Na2CO3��Ŀ���� ��
�ǰ���ʵ�鷽���õ�����Һ3�п϶����� ���ѧʽ�����ʣ�Ϊ�˽��������⣬��������Һ3�м��������� ��֮����Ҫ��ù���NaNO3����е�ʵ������� _________����������ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���淴ӦA��g��+B⇌C��g��+D�ﵽƽ��ʱ������˵������ȷ���ǣ�������
| �� | A�� | ������A��Ũ�ȣ�ƽ����ϵ��ɫ���D��һ���Ǿ�����ɫ������ |
| �� | B�� | ����ѹǿ��ƽ�ⲻ�ƶ���˵��B��D�������� |
| �� | C�� | �����¶ȣ�C�İٷֺ�����С��˵������Ӧ�Ƿ��ȷ�Ӧ |
| �� | D�� | ��B�����壬����A��Ũ�Ȼ�ʹB��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬ�¶��£������Ϊ0.25L�����������ܱ������з������淴Ӧ��
N2��g��+3H2��g��⇌2NH3��g����H=��92.6kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±���
| ���� ��� | ��ʼʱ�����ʵ����ʵ���/mol | ��ƽ��ʱ��ϵ�����ı仯 | ||
| N2 | H2 | NH3 | ||
| �� | 1 | 3 | 0 | �ų�������23.15 kJ |
| �� | 0.9 | 2.7 | 0.2 | �ų�������Q |
������������ȷ���ǣ�������
| �� | A�� | �����١����з�Ӧ��ƽ�ⳣ����� |
| �� | B�� | ƽ��ʱ������������NH3�����������Ϊ |
| �� | C�� | �������д�ƽ��ʱ�ų�������Q=23.15kJ |
| �� | D�� | �����������Ϊ0.5L����ƽ��ʱ�ų�������С��23.15kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�����������˵���У���ȷ���� ( )
A��2.4 g����þ����������ĿΪ0.2 NA
B��16 g CH4����ԭ����ĿΪNA
C��17 g NH3��������ԭ����ĿΪ4 NA
D��18 gˮ����������ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ԫ�����ڱ���Ԫ�������ɷ���������ƶϣ����д������( )
A.Be��ʧ����������þ�� B.Se���⻯���H2S�ȶ�
C.At���⻯�ﲻ�ȶ� D. �������ȱ��������Ƶļ���ǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com