
| A. | 1.0 mol | B. | 0.9 mol | C. | 0.85mol | D. | 0.8 mol |
分析 n(Cu)=$\frac{19.2g}{64g/mol}$=0.03mol,n(气体)=$\frac{5.6L}{22.4L/mol}$=0.25mol,结合原子守恒计算.
解答 解:n(Cu)=$\frac{19.2g}{64g/mol}$=0.03mol,n(气体)=$\frac{5.6L}{22.4L/mol}$=0.25mol,Cu与浓硝酸反应生成Cu(NO3)2、NOx、水,
由原子守恒可知,反应消耗的硝酸的物质的量是0.03mol×2+0.25mol=0.85mol,
故选C.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,把握Cu与浓硝酸的反应中硝酸作酸性和强氧化性为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键 | |
| B. | 水分子是一种极性分子,水分子空间结构呈直线型 | |
| C. | 冰与干冰都是分子晶体,其晶胞中分子的空间排列方式类似 | |
| D. | 水分子间通过H-O键形成冰晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,1 mol H2(g)与0.5 mol O2(g)的能量总和大于1 mol H2O(g)的能量 | |
| B. | 标准状况下,1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O放出的热量为241.8 kJ | |
| C. | 8 g水蒸气完全分解成氢气和氧气吸收483.6 kJ热量 | |
| D. | 常温下,2 mol H2与1 mol O2完全反应生成液态水放出的热量小于483.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
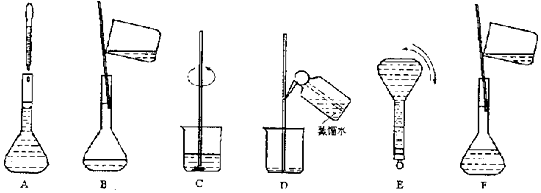
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有金属化合物才有焰色反应 | |
| B. | 焰色反应是化学变化 | |
| C. | 某溶液焰色反应呈黄色,则该溶液中含NaCl | |
| D. | 每次焰色反应实验时都要将铂丝蘸取盐酸洗涤并灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人 | |
| B. | NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头 | |
| C. | 可以用澄清石灰水来鉴别Na2CO3溶液中和NaHCO3溶液 | |
| D. | 往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
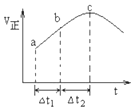 NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.在100℃1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).
NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.在100℃1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com