
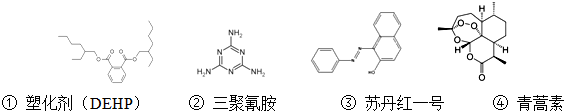
| A. | 塑化剂(DEHP)分子苯环上的二氯代物有六种不同的结构 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 苏丹红一号分子中所有原子可能在同一平面上 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
分析 A.DEHP结构对称,塑化剂(DEHP)分子苯环上的二氯代物有4种不同的结构;
B.根据结构简式确定分子式;
C.苏丹红一号分子中具有苯和乙烯结构特点;
D.过氧键具有强氧化性.
解答 解:A.DEHP结构对称,塑化剂(DEHP)分子苯环上的二氯代物有4种不同的结构,故A错误;
B.根据结构简式确定分子式为C3N6H6,故B正确;
C.苏丹红一号分子中具有苯和乙烯结构特点,乙烯和苯中所有原子共平面,所以苏丹红一号分子中所有原子可能在同一平面上,故C正确;
D.过氧键具有强氧化性,强氧化性物质能使蛋白质变性,所以青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关,故D正确;
故选A.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系水解本题关键,易错选项是A,注意DEHP苯环上二氯代物种类判断.


科目:高中化学 来源: 题型:选择题
| A. | 使用明矾可以对水进行消毒、杀菌 | |
| B. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| D. | 信息产业中的光缆的主要成分是单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al、Cu、Mg、Ag、Fe | B. | Fe、Cu、Al、Ag、Mg | C. | Mg、Ag、Al、Cu、Fe | D. | Mg、Cu、Al、Ag、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
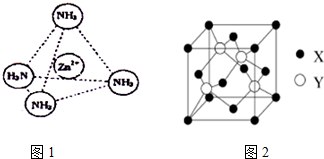
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 12种 | D. | 13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
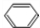 +HCHO+HCl$\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl$\stackrel{ZnCl_{2}}{→}$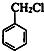 +H2O.
+H2O.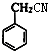 ;E的结构简式为
;E的结构简式为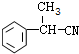 .
. .
.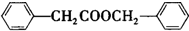 的合成路线
的合成路线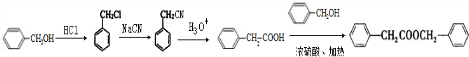 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 中和热的测定实验(如图).
中和热的测定实验(如图).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制容器可长期存放碱性食物 | B. | 水玻璃浸泡过的木材能防腐 | ||
| C. | 过氧化钠用作呼吸面具中的供氧剂 | D. | 氯气用于农药的生产和药物合成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com