
分析 CH2=CH-CH=CH2含有2个C=C键,与溴发生1:1加成时,可分别生成CH2Br-CHBrCH=CH2、CH2Br-CH=CH-CH2Br,与溴完全加成按1:2反应生成CH2Br-CHBrCHBrCH2Br,以此解答该题.
解答 解:CH2=CH-CH=CH2含有2个C=C键,可与溴按1:1、1:2加成,
(1)1,2加成发生CH2=CH-CH=CH2+Br2→CH2Br-CHBrCH=CH2,故答案为:CH2=CH-CH=CH2+Br2→CH2Br-CHBrCH=CH2;
(2)1,4加成发生CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br,故答案为:CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br;
(3)完全加成发生CH2=CH-CH=CH2+2Br2→CH2BrCHBrCHBrCH2Br,故答案为:CH2=CH-CH=CH2+2Br2→CH2BrCHBrCHBrCH2Br.
点评 本题考查化学方程式的书写,为高考高频点,明确有机物中官能团及其性质是解本题关键,知道反应时断键和成键方式,题目难度不大.


科目:高中化学 来源: 题型:选择题
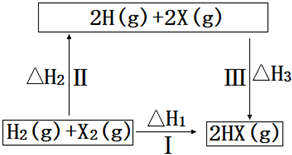
| A. | 2H(g)+2X(g)=2HX(g)△H3<0 | |
| B. | 途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | 途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定 | |
| D. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | NO2、CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氢氧化钠溶液,纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中只存在H+,不存在0H-,只有中性溶液或纯水中既有H+又有OH- | |
| B. | 温度越高,KW越大,所以温度高的溶液中的c(H+)一定比温度低的溶液中的c(H+)大 | |
| C. | 水的电离平衡受酸、碱和温度等条件的影响 | |
| D. | 向水中加人碱时,由于加人的OH-与水电离产生的H+作用.使c(H+)减小,平衡向电离的方向移动. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 | |
| B. | 在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 | |
| C. | 在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 | |
| D. | 没有使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol Al与足量NaOH溶液反应,生成的H2体积为6.72L | |
| B. | 常温下pH=1的盐酸溶液中的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.3NA | |
| D. | 11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com