

分析 (Ⅰ)(1)①根据物质的性质和质量守恒定律书写化学方程式;
②检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在氯离子;
(2)在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应;
(Ⅱ)粗铜中加入稀硝酸,Fe、Cu和稀硝酸反应生成Fe(NO3)3、Cu(NO3)2,同时生成氮氧化物,氮氧化物和水反应生成硝酸,能循环利用,调节溶液的pH,将Fe(NO3)3转化为Fe(OH)3沉淀,然后过滤得到滤渣,滤液为Cu(NO3)2溶液,向滤液中加入稀硝酸并调节溶液的pH,然后蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体.
(1)氮氧化物和氧气、水反应生成硝酸,提高原料利用率;
(2)A.在溶解度曲线上方的溶液为过饱和溶液;
B.B点时两种晶体在水溶液中都达到饱和;
C.结晶温度较低,晶体Cu(NO3)2•6H2O析出;
D.若将C点时的溶液降温至30°C以下,如果溶液为过饱和溶液,可以析出Cu(NO3)2•6H2O晶体;
(3)正极上氧气得电子发生还原反应;根据氢氧化钠计算转移电子数,根据串联电池中转移电子数相等计算丁烷的体积.
解答 解:(Ⅰ)(1)①设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl,
故答案为:TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl;
②沉淀吸附溶液中的Cl-,根据发生反应:Cl-+Ag+═AgCl↓,取最后一次的少量洗涤液,检验溶液中溶解的离子是否还存在,
故答案为:取最后一次的少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(2)在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,反应方程式为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应,
故答案为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti;
(Ⅱ)粗铜中加入稀硝酸,Fe、Cu和稀硝酸反应生成Fe(NO3)3、Cu(NO3)2,同时生成氮氧化物,氮氧化物和水反应生成硝酸,能循环利用,调节溶液的pH,将Fe(NO3)3转化为Fe(OH)3沉淀,然后过滤得到滤渣,滤液为Cu(NO3)2溶液,向滤液中加入稀硝酸并调节溶液的pH,然后蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体.
(1)氮氧化物有毒,且NO不和水反应,通入氧气和水,氮氧化物和氧气、水反应生成硝酸,硝酸能循环利用,从而提高原料利用率,且减少污染物的排放,
故答案为:将NOx转化为硝酸,提高原料的利用率,减少污染物的排放;
(2)A.在溶解度曲线上方的溶液为过饱和溶液,所以A点时的溶液为饱和溶液,故A错误;
B.根据图象知,B点时两种晶体在水溶液中都达到饱和,所以二者可以共存,故B正确;
C.结晶温度较低,晶体以Cu(NO3)2•6H2O析出,故C错误;
D.若将C点时的溶液降温至30°C以下,如果溶液为过饱和溶液,根据图象知,可以析出Cu(NO3)2•6H2O晶体,故D正确;
故答案为:BD;
(3)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-,氢氧化钠的物质的量=3.25mol/L×0.2L=0.65mol,根据2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-知,生成0.65mol氢氧化钠时转移电子的物质的量=$\frac{0.65mol}{2}$,串联电池中转移电子数相等,所以丁烷的体积=$\frac{0.65mol}{6.5×4}$=560mL,
故答案为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-;560.
点评 本题考查学生对工艺流程理解、阅读题目获取信息能力、盐类水解原理、原电池原理及方程式的书写等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
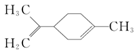 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 分子式为C10H14 | |
| B. | 一定条件下,柠檬烯可以发生加成、取代、氧化、还原反应 | |
| C. | 柠檬烯有属于苯的同系物的同分异构体 | |
| D. | 柠檬烯的分子中所有碳原子可能处在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
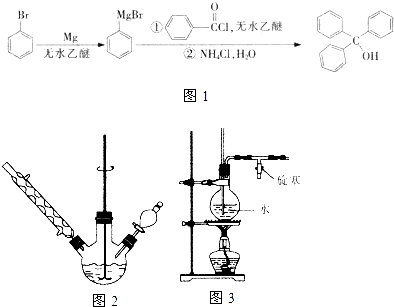 三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
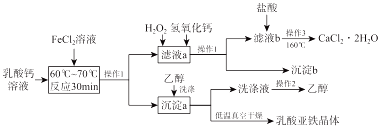
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
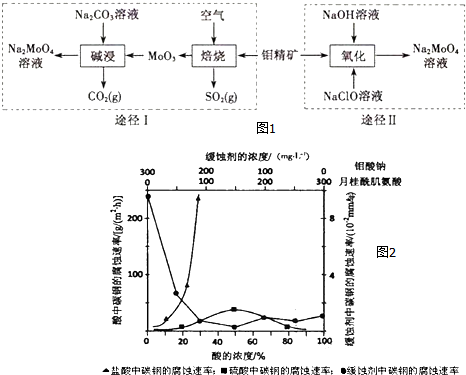
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com