
【题目】下列有关图的分析中,不正确的是( )

A. 如果该图为组成活细胞中的元素,则A是氧元素
B. 如果该图表示的菠菜叶肉细胞中的元素,则其中Mo的含量很少
C. 如果该图表示的是组成骨骼肌细胞的化合物,则A是蛋白质
D. 如果该图为组成大豆细胞的有机物,则A肯定含有的元素是C、H、0、N
科目:高中化学 来源: 题型:
【题目】X、Y、W、Q四种元素在元素周期表中的位置如图,下列叙述错误的是

A. Y的氢化物沸点高于Q的氢化物沸点
B. 原子半径顺序为:r(W)>r(Q)>r(Y)>r(X)
C. 最高正价与最低负价之和为0的元素只有W
D. X、Y、Q三元素形成的分子中,原子最外层电子数之和最大为32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在密闭容器中采下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。
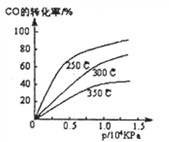
①该反应△H_______0(填“>”或“<”),则该反应__________自发进行(填“一定能”、“一定不能”、“ 不一定”)
②实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_____________。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.1mol·L-1。
①若此时向体系中再充入0.6mo1CO和0.6mo1CH3OH,则平衡__________(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)
②在其他条件不变的情况下,将容器体积压缩到原来的![]() ,与原平衡相比,下列有关说法正确的是_________(填序号)。
,与原平衡相比,下列有关说法正确的是_________(填序号)。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
③若保持同一温度起始投料为amolCO、bmolH2、cmolCH3OH,欲使平衡混合物中各组成与原平衡相同,且开始时该反应向逆反应方向进行,c的取值范围是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列基态原子或离子的电子排布式错误的是( )
A. .Cr:[Ar]3d44s2 B. F-:1s22s22p6
C. K+:1s22s22p63s23p6 D. S:1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Mg2+、Na+、SO42﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Na+、K+、OH﹣、Cl﹣
D.Ba2+、CO32﹣、NO3﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
【答案】D
【解析】试题分析:A.相同浓度的氨水与盐酸,氨水实际上还会促进水的电离,所以由水电离产生的c(H+):①>③,B.如果③是强碱的话,稀释100倍,其pH一定为11,但是关键氨水是弱碱,无论稀释到什么程度,都会有未电离的氨水存在,所以pH一定比11要小。C.①与③混合得到的是氯化铵,氯化铵是强酸弱碱盐,显酸性,所以若想要其pH为7,则氨水的用量一定要比盐酸的用量大才可以。D.所得溶液显碱性,所以氢氧根离子的浓度一定要比氢离子的浓度大,而且铵根离子的浓度要比氯离子的浓度大。
考点:考查了弱电解质的电离平衡、盐类水解、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
18
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
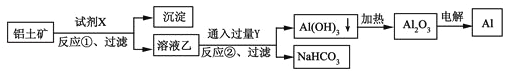
A. 试剂X氢氧化钠溶液
B. 反应①、过滤后所得沉淀为红褐色Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是组成细胞的主要元素及其比例。根据图示信息完成下列问题:

(1)构成细胞的基本元素有____________。
(2)组成生物体的最基本元素占细胞鲜重的________。
(3)________元素在细胞鲜重总量中所占比例最大,主要是因为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分利用碳的氧化物合成化工原料,既可以减少环境污染和温室效应,又能变废为宝。
Ⅰ.CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)O2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
(2)对于CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。
CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。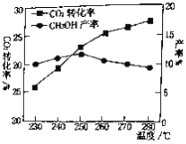
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
Ⅱ.CO是合成尿素、甲酸的原料。
(3)合成尿素的反应:2NH3(g)+CO(g)![]() CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
①T℃时,在体积为2L的恒容密闭容器中,将2molNH3和1molCO混合发生反应,5min时,NH3的转化率为80%。则0~5min内的平均反应速率为v(CO)=___________。
②已知:
温度/K | 398 | 498 | … |
平衡常数/K | 126.5 | K1 | … |
则:K1___________126.5(填“>”或“<”);其判断理由是___________。
(4)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1mol·L-1的HCOOH和HCOONa混合溶液pH=3.7,则HCOOH的电离常数Ka的值为___________ (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为___________;忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com