
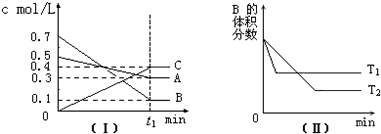
| A、在 t1时间内用B表示该反应的平均速率为0.4/t1mol?L-1?min-1 |
| B、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| C、T℃时,在相同容器中,若由0.3mol?L-1A、0.1 mol?L-1 B和0.4 mol?L-1 C反应,达到平衡后,C的浓度仍为0.4 mol?L-1 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
| △c |
| △t |
| 0.6mol/L |
| t 1 |
| 0.6 |
| t 1 |
| (0.4) 2 |
| 0.3×(0.1)3 |
| 1600 |
| 3 |
| (0.4) 2 |
| 0.3×(0.1)3 |
| 1600 |
| 3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
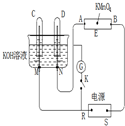 如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.
如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入催化剂能加快NH3转化为NO |
| B、配制FeCl3溶液时,向溶液中加入少量盐酸 |
| C、往醋酸溶液中加少量碱,有利于CH3COO-的增多 |
| D、往醋酸钠溶液中加入纯醋酸,可以抑制CH3COONa的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯化铁浓溶液和氢氧化钠浓溶液混合,能得到氢氧化铁胶体 |
| B、胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸 |
| C、利用丁达尔效应可以区分溶液和胶体 |
| D、浊液的分散质粒子直径大于l00nm,不能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com