
【题目】某锂-空气电池放电时的工作原理如图所示。下列叙述正确的是( )
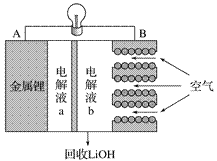
A. 放电时电子由B极经导线向A极移动
B. 电池放电时B电极的反应式为O2 +2H2O + 4e-===4OH -
C. 电解液a、b之间可采用阴离子交换膜
D. 当A电极消耗14g金属锂时,B电极有标况下22.4L氧气参与反应
科目:高中化学 来源: 题型:
【题目】⑴现有分子式为CllH16的一烷基取代苯,已知它可以被酸性KMnO4溶液氧化成为![]() ,它的异构体共有7种,其中的3种是
,它的异构体共有7种,其中的3种是![]() 、
、![]() 、
、![]()
请写出其他4种的结构简式:____________________、______________________ 、
_____________________、__________________________。
(2)化合物甲:![]() 能使Br2的CCl4溶液褪色,写出甲与Br2发生等物质的量加成反应时可能产物的结构简式_________ ,_____________,_____________。
能使Br2的CCl4溶液褪色,写出甲与Br2发生等物质的量加成反应时可能产物的结构简式_________ ,_____________,_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在一个10L恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
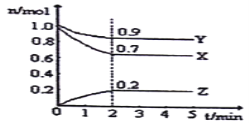
(1)该反应的化学方程式为_________________。
(2)反应开始至2min,以气体X表示的平均反应速率为________________。
(3)平衡时容器内气体的压强与起始时比________________(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比________________。
(4)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=____。
Ⅱ.在恒温恒压的密闭容器中,当下列物理量不再发生交化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2NO2(g)![]() N2O4(g)达到平衡状态的是________(填序号,下同)。
N2O4(g)达到平衡状态的是________(填序号,下同)。
(2)一定能证明NH2COONH4(s)![]() CO2(g)+2NH3(g)达到平衡状态的是______。
CO2(g)+2NH3(g)达到平衡状态的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-546.6 kJ/mol,下列说法正确的是 ( )
A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于546.6 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF的能量
D. 该反应中的能量变化可用如图来表示
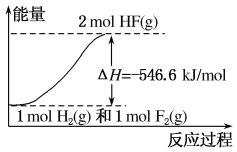
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+ 5B(g)== 4C(g)+ 6D(g)在10L的密闭容器中进行,半分钟后,D的物质的量增加了0.45mol,则此反应的平均速率v(x)可表示为( )
A. v(A)=0.0010mol·L-1·s-1
B. v(B)=0.0010mol·L-1·s-1
C. v(C)=0.010mol·L-1·s-1
D. v(D)=0.045mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的产物并不改变的是( )
A. Na和O2 B. NaOH和CO2 C. Na2O2和CO2 D. 木炭(C)和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0。达到平衡后,以下分析正确的是
2SO3(g)△H<0。达到平衡后,以下分析正确的是
A. 减小生成物浓度,对正反应的反应速率影响更大
B. 扩大容器体积,对正反应的反应速率影响更大
C. 降低温度,对正反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中:2A(g)+B(g)![]() 2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
A. 3.4 mol B. 3.2 mol C. 2.8 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com