
����Ŀ����ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1 mol��ˮ������Ϊ100 g������˵����ȷ����(����)

A. Na2O2������������Ŀ֮��Ϊ1��1
B. ��Ӧ�ٵ����ӷ���ʽΪNa��2H2O===Na����2OH����H2��
C. ���������۳�ַ�Ӧ��������Һ�����ʵ�������������>��>��
D. ��Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ0.1mol
���𰸡�C
��������
����A.������������������O22-����������������Ŀ֮��Ϊ1��2������B����Ӧ�������ӷ���ʽΪ��2Na+2H2O=2Na++2OH-+H2��������C����Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2��ת�Ƶ���2e-����0.1mol�������Ʒ�Ӧ�����ת��0.1 mol���ӣ���ȷ��D���ơ������ơ��������ƺ�ˮ��Ӧ�ķ���ʽ�ֱ����£�
Na+1/2H2O=NaOH+1/2H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��Na2O+H2O=2NaOH����Һ���ӵ�����=m��Na2O��=0.1mol��62g/mol=6.2g��Na2O2+H2O=2NaOH+1/2O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g,������Һ���ӵ�������С˳��Ϊ���ƣ�������=�������ƣ�������ԭ���غ�֪��0.1mol���ơ������ơ��������ơ�����ˮ�����������Ƶ����ʵ����ֱ�Ϊ��0.1mol��0.2mol��0.2mol��ͨ�����Ϸ�����֪��0.1mol���ơ������ơ��������ơ��ֱ�����ˮ������Һ�����������ֱ�Ϊ��4/(100+2.2)��100%��8/(100+6.2)��100%��8/(100+6.2)��100%������������������ַ�Ӧ��������Һ�����������Ӵ�С��������=��������,ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᾧ��(H2C2O4��2H2O)��ɫ���۵�Ϊ101��,������ˮ��������ˮ������,170�����Ϸֽ⡣ijѧ��������ͼװ�������ᾧ��ķֽ�ʵ�鲢��֤���ֲ������˵���������
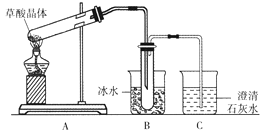
A. װ��A�еĴ��Թܿ�Ӧ��������б������Ϊ���Ȳ��ᾧ��ʱ�����ˮ
B. װ��B����Ҫ����������(ˮ����������)��,��ֹ�������װ��C��,����CO2�ļ���
C. װ��C�пɹ۲쵽��������������ð��,����ʯ��ˮ�����
D. ��ʵ����֤�����ᾧ��ķֽ�����ж�����̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����ֻ�ձ��и�ʢ��100 Ml 2.5 mol��L��1�������NaOH��Һ������ֻ�ձ��зֱ��������������ۣ���Ӧ�����������ɵ�����������ΪV(��)��V(��)=5��6����������۵�����Ϊ
A. 10.8g B. 3.6g C. 5.4g D. 2.7g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���ﺬ��NO������������ȼ��ȼ�յĸ�����������������Ӧ����:N2(g)+O2(g)![]() 2NO(g)����H>0����֪�÷�Ӧ��2 404 ��ʱ,ƽ�ⳣ��K=64��10-4����ش�:
2NO(g)����H>0����֪�÷�Ӧ��2 404 ��ʱ,ƽ�ⳣ��K=64��10-4����ش�:
��1��ij�¶���,��2 L���ܱ������г���N2��O2��1 mol,5���Ӻ�O2�����ʵ���Ϊ0.5 mol,��N2�ķ�Ӧ����Ϊ___��
��2���ٶ��÷�Ӧ���ں��������½���,�жϸ÷�Ӧ�ﵽƽ��ı�־___(����ĸ���)��
A.����1 mol N2ͬʱ����1 mol O2
B.��������ܶȲ���
C.�������ƽ����Է�����������
D.2v��(N2)=v��(NO)
��3����N2��O2�Ļ�����������º����ܱ�������,���б仯������ȷ����__(����ĸ���)��

��4������º��ݵ��ܱ������г�������ʵ�����N2��O2,�ﵽƽ��״̬���������г���һ����NO,���´ﵽ��ѧƽ��״̬����ԭƽ��״̬���,��ʱƽ����������NO���������_____(�������������С������������)��
��5�����¶���,ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1 mol��L-1��4.0��10-2 mol��L-1��3.0��10-3 mol��L-1,��ʱ��Ӧ________________(�������ڻ�ѧƽ��״̬����������Ӧ����������������淴Ӧ���������),������_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. �����ܽ�ˮ���е�CaCO3��CaCO3��2H�� = Ca2����H2O��CO2��
B. NaAlO2��Һ��ͨ�����CO2�� AlO2��+CO2+2H2O = Al(OH)3��+HCO3��
C. ���ȵ�NaOH��Һ�ܽ�S��3S��4OH��![]() 2S2����SO2����2H2O
2S2����SO2����2H2O
D. ϡ����������������Һ��Ӧ��H+ + OH����SO42��+ Ba2��= BaSO4�� + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ʵ���Ҳ���MgCl2��AlCl3�Ļ����Һ�������ˮ��Ӧ�Ʊ�MgAl2O4����Ҫ�������£�
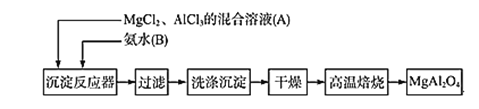
��1��д��AlCl3�백ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽ _________________________________��
��2���ж������г����Ƿ�ϴ���ķ�����__________________________________________�����±���ʱ������ʢ�Ź��������������________________��
��.��ˮAlCl3(183 ������)����ʪ��������������������ʵ���ҿ�������װ���Ʊ���
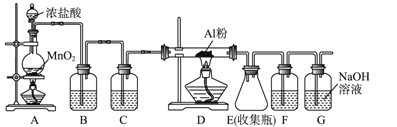
��3������װ��A�����Ʊ�������д���仯ѧ��Ӧ����ʽ______________________��
��4��װ��B��ʢ�ű���NaCl��Һ����װ�õ���Ҫ������_____________________��
��5��F���Լ���________��GΪβ������װ�ã����з�Ӧ�����ӷ���ʽ��____________________��
��6���Ʊ������ķ�Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ�������ʵ�鷽����������AgNO3��Һ��Ӧ���������ɵ�AgCl�������˷���_______������С����������С�����������__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ġ��������Ʒ����5mol/L����0.14Lǡ����ȫ��Ӧ��������Һ�������ձ�״����2.24L������ʹ����Fe2+ȫ��ת��ΪFe3+������Ʒ���ܵĻ�ѧʽ�ǣ�������
A. Fe5O6 B. Fe3O4 C. Fe6O7 D. Fe5O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊ�����ӵ�������ֵ������˵����ȷ����
Ϊ�����ӵ�������ֵ������˵����ȷ����
A. 0.1 mol ��![]() ������
������![]() ������
������
B. pH=1��H3PO4��Һ�У�����![]() ��
��![]()
C. 2.24L����״��������O2����ȫȼ�գ��õ�![]() ��CO2����
��CO2����
D. �ܱ�������1 mol PCl3��1 mol Cl2��Ӧ�Ʊ� PCl5��g��������![]() ��P-Cl��
��P-Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�������ö������̺�Ũ���ᷴӦ��ȡCl2����ѧ����ʽ���£� MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��1�����õ����ű���÷�Ӧ����ת�Ƶķ������Ŀ___________���÷�Ӧ������������___________��
��2�������������뻹ԭ�������ʵ���֮����___________����ʵ������87g��MnO2��ȫ��Ӧ�����Ƶõ�Cl2�ڱ���µ������___________L��
������㷺Ӧ����ϡ�н�����ʪ��ұ��ƯȾ��ҵ�������ӹ�����ҩƷ���л�ҩ��������������С�HCl��������ˮ����ҵ����HCl��������ˮ�ķ�����ȡ���ᡣ
��1�����ܶ�Ϊ1.2 g/mL����������Ϊ36.5%��Ũ��������250mL 3mol/L��ϡ���ᣬ��Ҫ����Ͳ��ȡŨ��������Ϊ________mL��
��2����Һ��������Ҫ�IJ����������ձ�������������Ͳ��___________��___________��
��3��ʵ������У����в����ᵼ������������ҺŨ��ƫ�ߵ���____________��
A����ȡŨ����ʱ���ӿ̶��� B��ʵ��ǰ������ƿ����������������ˮ
C������ʱ���ӿ̶��� D��ת��ʱ��δϴ���ձ��Ͳ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com