
某药物中间体的合成路线如下:下列说法正确的是
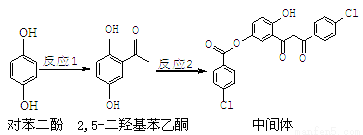
A.对苯二酚在空气中能稳定存在
B.1 mol该中间体最多可与11 mol H2反应
C.2,5-二羟基苯乙酮能发生加成、水解、缩聚反应
D.该中间体分子中含有羰基和烃基两种含氧官能团
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届山东省泰安市高三上学期期中化学试卷(解析版) 题型:填空题
A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
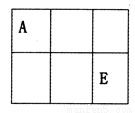
(1)C在元素周期表中的位置为________,其离子的结构示意图为________________。
(2)AE2的分子式为______________。
(3)C、E、F的单质沸点最低的是__________(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___________(填离子符号)。
(5)实验室制取F2气体的离子方程式为____________。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:简答题
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:
C(s)+H2O(g) CO(g)+H2(g)ΔH=+131.4kJ/mol
CO(g)+H2(g)ΔH=+131.4kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密 度增
度增 大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
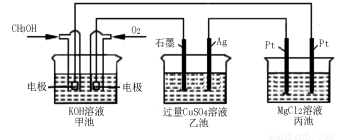
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当 甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:选择题
利用已有的实验器材,规格和数量不限,能完成相应实验的是( )
实验器材(省略夹持装置) | 相应实验 | |
A | 烧杯、玻璃棒、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的结晶 |
C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5 mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省、兴国三中等四校高三上第一次联考化学卷(解析版) 题型:选择题
向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol ·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是

A.a点时溶液中所含主要溶质为(NH4)2SO4
B.a→b段发生反应的离子方程式是 SO +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C.b点为最大沉淀量,对应的纵坐标值为0.02
D.c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源:2017届江西省、兴国三中等四校高三上第一次联考化学卷(解析版) 题型:选择题
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应
②弱酸与盐溶液反应可生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
⑤有单质参加的非氧化还原反应
⑥两种含氧化合物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:实验题
氮的氧化物(NOx)是大气污染物之一。工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),常见处理法有:
(1)可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx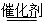 (2x+3)N2+6xH2O
(2x+3)N2+6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:

①装置A中发生反应的化学方程式为________________________________。
②装置D中碱石灰的作用是____________________。
(2)用Na2CO3溶液吸收法处理NOx。已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3===2NaNO2+CO2 (Ⅰ)
2NO2+Na2CO3===NaNO2+NaNO3+CO2 (Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是________(填字母)。
A.1.9 B.1.7 C.1.5 D.1.3
②用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则NOx中的x值为________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:选择题
如图为雾霾的主要成分示意图。下列说法不正确的是( )

A.SO2和NxOy都属于酸性氧化物
B.雾属于胶体,能产生丁达尔效应
C.重金属离子可导致蛋白质变性
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高一上期中化学试卷(解析版) 题型:选择题
已知I-、2Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的 顺序为SO2>I->2Fe2+>H2O2>Cl-,则下列反应不可能发生的是
顺序为SO2>I->2Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ B.I2+SO2+2H2O=H2SO4+2HI
C.2Fe2++I2=2Fe3++2I- D.H2O2+ SO2= H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com