
| A. | 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在 | |
| B. | 用酸性KMnO4溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙稀 | |
| C. | 用溴水鉴别乙烯与乙炔 | |
| D. | CH4和Cl2在光照条件下反应的产物最多可能有四种 |
分析 A、检验有机物中的卤原子是否存在的步骤是:NaOH水溶液共热→冷却→加硝酸酸化→加AgNO3溶液→看是否有沉淀;
B、溴乙烷与NaOH醇溶液共热后的产物为乙烯;
C、乙烯和乙炔中均含不饱和键,均能发生加成反应;
D、CH4和Cl2在光照条件下发生取代反应,除了生成有机产物,还有无机产物HCl生成.
解答 解:A、取少量卤代烃加NaOH水溶液共热,冷却,冷却后,要先用硝酸酸化再加AgNO3溶液检验卤原子存在,故A错误;
B、溴乙烷与NaOH醇溶液共热后,发生消去反应,生成乙烯,可用酸性KMnO4溶液检验,故B正确;
C.乙烯和乙炔都为不饱和烃,都可与溴水发生加成反应使其褪色,不能鉴别,故C错误;
D、CH4和Cl2在光照条件下发生取代反应,除了生成有机产物一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳,还有无机产物HCl生成,即共有5种产物,故D错误.
故选B.
点评 本题考查了有机物的检验和鉴别,应注意的是检验卤代烃中的卤素原子时,应先让卤代烃发生水解或取代反应,再加硝酸中和NaOH,然后再加硝酸银,通过产生沉淀的颜色来判断卤代烃中卤素原子的种类.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
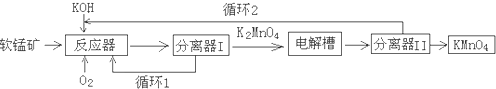
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

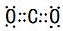 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 向硫酸铝溶液中滴加过量的氢氧化钡溶液 | 产生白色沉淀 | 氢氧化铝不溶于过量的氢氧化钡溶液 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
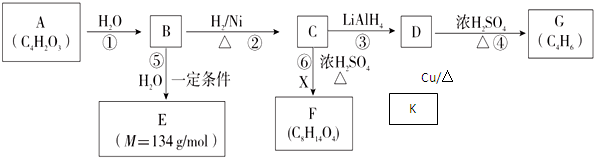
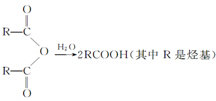 ②R-COOH$\stackrel{LiAlH_{4}}{→}$R-CH2OH(其中R是烃基)
②R-COOH$\stackrel{LiAlH_{4}}{→}$R-CH2OH(其中R是烃基)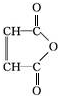 ;B中含氧官能团的名称是羧基;
;B中含氧官能团的名称是羧基;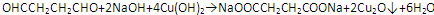
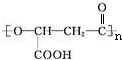 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2 种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2 种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | 氯化亚铁溶液中加入硝酸:Fe2++4H++NO3-=Fe3++2H2O+NO↑ | |
| C. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 氨水中通入过量CO2:2NH3•H2O+CO2=2NH4++CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P原子:1s2 Q原子:2s2 | |
| B. | P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子 | |
| C. | P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子 | |
| D. | P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com